题目内容
将30 g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了14 g,则混合气体中CH4和C2H4的体积之比为
- A.1∶2
- B.2∶1
- C.3∶2
- D.2∶3
B
试题分析:CH4和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重14g为C2H4质量,
所以n(C2H4)=14g÷28g/mol=0.5mol。
所以C2H4的体积为0.5mol×22.4L/mol=11.2L。CH4的质量为30g-14g=16g。
所以CH4体积为=16g÷16g/mol=1mol。所以C2H4的体积为1mol×22.4L/mol=22.4L。
所以混合气体中CH4和C2H4的体积之比为2∶1。
故选B。
考点:有关混合物反应的计算
点评:考查混合物的有关计算及烯的性质,难度不大,关键明白烯与溴发生加成反应,甲烷与溴水不反应。
试题分析:CH4和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重14g为C2H4质量,
所以n(C2H4)=14g÷28g/mol=0.5mol。
所以C2H4的体积为0.5mol×22.4L/mol=11.2L。CH4的质量为30g-14g=16g。
所以CH4体积为=16g÷16g/mol=1mol。所以C2H4的体积为1mol×22.4L/mol=22.4L。
所以混合气体中CH4和C2H4的体积之比为2∶1。
故选B。
考点:有关混合物反应的计算
点评:考查混合物的有关计算及烯的性质,难度不大,关键明白烯与溴发生加成反应,甲烷与溴水不反应。

练习册系列答案
相关题目
将30 g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了14 g,则混合气体中CH4和C2H4的体积之比为( )
| A.1∶2 | B.2∶1 | C.3∶2 | D.2∶3 |
(13分)
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
①
CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
②
CO(g)+2H2(g)  CH3OH(g) △H2
CH3OH(g) △H2
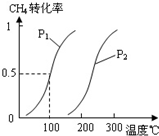
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)反应①的△H1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
I |
150 |
1/3 |
0.1 |
|
II |
|
|
5 |
|
III |
350 |
|
5 |
 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题: