题目内容
14.据报道用Mg与作电极与NH4Cl溶液形成原电池,也可生成NH3.下列说法不正确的是( )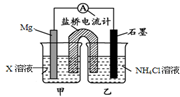
| A. | 盐桥中的K+移向乙烧杯 | |
| B. | 乙烧杯中一直存在:c(Cl-)>c(NH4+) | |
| C. | X可能是CuCl2 | |
| D. | 石墨电极反应式为2NH4++2e-═2NH3↑+H2↑ |
分析 依据原电池的原理结合电池反应,反应的总反应式为Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,正极为石墨,是铵根得到电子发生还原反应,负极是镁失电子发生氧化反应,据此解答即可.
解答 解:A.溶液中的阳离子流向正极,故盐桥中的钾离子经溶液流向乙烧杯,故A正确;
B.乙烧杯中由于铵根放电,故铵根浓度随着反应进行,逐渐减小,故说法一直存在:c(Cl-)>c(NH4+)正确,故B正确;
C.镁可与氯化铜反应,X不能与镁发生氧化还原反应,X可以是氯化镁,故C错误;
D.反应的总反应式为Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,则NH4+在正极(石墨)上得电子生成NH3和H2,发生还原反应电极反应式为:2NH4++2e-=2NH3↑+H2↑,故D正确;
故选C.
点评 本题主要考查的是原电池原理,依据题给信息得出电极反应式是解决本题的关键,牵涉离子浓度变化、盐桥中阴阳离子流动方向分析,综合性较强.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
4.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | Cl2O7、P2O5、SO3、CO2均属于酸性氧化物 | |
| B. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
2.下列有关化学反应的说法正确的是( )
| A. | 在氧化还原反应中,阴离子只能发生氧化反应 | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 有些吸热反应不需要加热也能进行 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
9.下列有关实验装置的说法中正确的是( )
| A. | 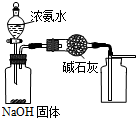 用图装置制取干燥纯净的NH3 | |
| B. | 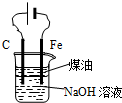 用图装置实验室制备Fe(OH)2 | |
| C. |  用图装置可以完成“喷泉”实验 | |
| D. |  用图装置测量Cu与浓硝酸反应产生气体的体积 |
19.一定条件下,碳单质和二氧化碳气体可以反应生成一氧化碳气体,该反应的类型为( )
| A. | 吸热反应 | B. | 离子反应 | C. | 复分解反应 | D. | 非氧化还原反应 |
6.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
| A. | 电子由Zn电极流出,经KOH溶液流向正极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |

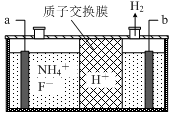 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.