题目内容
现对0.1mol/L的纯碱溶液进行相关研究.
(1)用pH试纸测定该溶液的pH,其正确的操作
(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因:
(3)某同学根据所学知识对Na2CO3溶液进行分析,写出了以下四个关系式.请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式.
①c(Na+)=2[c(CO32-)+c(HCO3-)]:
②c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-):
③c(OH-)=c(H+)+c(HCO3-)+c(H2CO3):
④c(Na+)>c(CO32-)>c(OH-)>c(HCO3-):
(1)用pH试纸测定该溶液的pH,其正确的操作
用玻璃棒蘸取待测液,滴在pH试纸上,颜色变化后与标准比色卡对比
用玻璃棒蘸取待测液,滴在pH试纸上,颜色变化后与标准比色卡对比
.(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因:
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(3)某同学根据所学知识对Na2CO3溶液进行分析,写出了以下四个关系式.请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式.
①c(Na+)=2[c(CO32-)+c(HCO3-)]:
c(Na+)=
[c(CO32-)+c(HCO3-)+c(H2CO3)]
| 1 |
| 2 |
c(Na+)=
[c(CO32-)+c(HCO3-)+c(H2CO3)]
;| 1 |
| 2 |
②c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-):
√
√
;③c(OH-)=c(H+)+c(HCO3-)+c(H2CO3):
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
;④c(Na+)>c(CO32-)>c(OH-)>c(HCO3-):
√
√
.分析:(1)测定pH的步骤为蘸、滴、对比;
(2)碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
(3)Na2CO3溶液中,存在物料守恒式为c(Na+)=
[c(CO32-)+c(HCO3-)+c(H2CO3)],电荷守恒式为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),并结合水解显碱性来分析解答.
(2)碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
(3)Na2CO3溶液中,存在物料守恒式为c(Na+)=
| 1 |
| 2 |
解答:解:(1)测定pH的步骤为用玻璃棒蘸取待测液,滴在pH试纸上,颜色变化后与标准比色卡对比,然后确定溶液的pH,
故答案为:用玻璃棒蘸取待测液,滴在pH试纸上,颜色变化后与标准比色卡对比;
(2)碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性,离子反应为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)①Na2CO3溶液中,存在物料守恒式为c(Na+)=
[c(CO32-)+c(HCO3-)+c(H2CO3)],显然c(Na+)=2[c(CO32-)+c(HCO3-)]关系错误,
故答案为:c(Na+)=
[c(CO32-)+c(HCO3-)+c(H2CO3)];
②Na2CO3溶液中,溶液不显电性,由电荷守恒可知c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故答案为:√;
③Na2CO3溶液中,由质子守恒可知,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故答案为:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);
④Na2CO3溶液中,由化学式可知,c(Na+)>c(CO32-),又由CO32-+H2O?HCO3-+OH-,则离子浓度关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),
故答案为:√.
故答案为:用玻璃棒蘸取待测液,滴在pH试纸上,颜色变化后与标准比色卡对比;
(2)碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性,离子反应为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)①Na2CO3溶液中,存在物料守恒式为c(Na+)=
| 1 |
| 2 |
故答案为:c(Na+)=
| 1 |
| 2 |
②Na2CO3溶液中,溶液不显电性,由电荷守恒可知c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故答案为:√;
③Na2CO3溶液中,由质子守恒可知,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故答案为:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);
④Na2CO3溶液中,由化学式可知,c(Na+)>c(CO32-),又由CO32-+H2O?HCO3-+OH-,则离子浓度关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),
故答案为:√.
点评:本题考查盐类水解及离子浓度的关系,明确溶液中的三个守恒式及水解反应是解答本题的关键,注意pH测定的规范操作,题目难度不大.

练习册系列答案
相关题目
碳酸钠、碳酸氢钠是两种重要的化学试剂.根据要求回答:
Ⅰ.兴趣小组设计三种方案,鉴别浓度均为0.01mol?L-1碳酸钠和碳酸氢钠两种溶液:
(1)甲方案中pH较大的是 ;
(2)结果表明方案乙无法实现鉴别目的,用离子方程式表示方案乙发生的反应: ; .
(3)经过查阅资料获得如下信息:Ksp(CaCO3)=4.96×10-9;0.01mol?L-1 NaHCO3、Na2CO3溶液中
c(CO32-)如表所示:
丙方案能否实现鉴别目的? ;理由是 ;
Ⅱ.纯碱生产过程中,所得产品往往混有一定量的氯化钠.为检测纯碱的纯度,可采用多种方案来进行.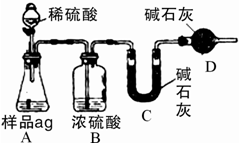
(4)如图为学生丁设计的方案,试图通过测定样品(a g)与足量的稀硫酸反应产生的CO2质量来实现目的.
①本方案存在缺陷,对纯碱纯度检测的影响.
缺陷: ;所测纯碱的纯度将 (填“偏大”或“偏小”).
②方案经改进后,丁进行了实验,并测得B、C、D三套装置的质量分别增重了m1、m2和m3.则纯碱的纯度为 .
(5)现只有少量(约1g)纯碱样品、0.100mol?L-1硫酸和蒸馏水,同学戊拟通过测定一定质量的纯碱样品与硫酸反应时消耗硫酸体积来确定纯碱的纯度.实验过程中,需用 (填仪器名称)测量硫酸的体积,而且实验过程中还需用到的一种试剂是 .
Ⅰ.兴趣小组设计三种方案,鉴别浓度均为0.01mol?L-1碳酸钠和碳酸氢钠两种溶液:
| 序号 | 甲 | 乙 | 丙 |
| 方案 | 用广泛pH试纸 检测溶液pH |
滴加等体积0.1mol?L-1 Ba(OH)2溶液 |
滴加等体积0.1mol?L-1 CaCl2溶液 |
(2)结果表明方案乙无法实现鉴别目的,用离子方程式表示方案乙发生的反应:
(3)经过查阅资料获得如下信息:Ksp(CaCO3)=4.96×10-9;0.01mol?L-1 NaHCO3、Na2CO3溶液中
c(CO32-)如表所示:
| 0.01mol?L-1溶液 | NaHCO3 | Na2CO3 |
| c(CO32-)/mol?L-1 | 0.00011 | 0.0087 |
Ⅱ.纯碱生产过程中,所得产品往往混有一定量的氯化钠.为检测纯碱的纯度,可采用多种方案来进行.

(4)如图为学生丁设计的方案,试图通过测定样品(a g)与足量的稀硫酸反应产生的CO2质量来实现目的.
①本方案存在缺陷,对纯碱纯度检测的影响.
缺陷:
②方案经改进后,丁进行了实验,并测得B、C、D三套装置的质量分别增重了m1、m2和m3.则纯碱的纯度为
(5)现只有少量(约1g)纯碱样品、0.100mol?L-1硫酸和蒸馏水,同学戊拟通过测定一定质量的纯碱样品与硫酸反应时消耗硫酸体积来确定纯碱的纯度.实验过程中,需用
