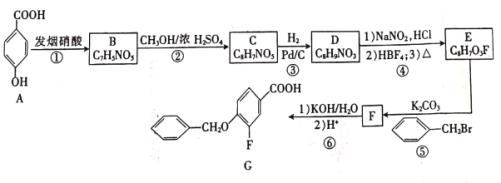
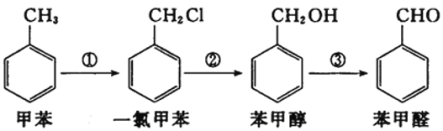
题目内容
【题目】一种利用电化学变色的装置如图所示,其工作原理为:在外接电源下,通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节。已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。下列有关说法错误的是

A.当a接外接电源负极时,电致变色层、离子储存层都显蓝色,可减小光的透过率
B.当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3
C.切换电源正负极使得蓝色变为无色时,Li+通过离子导体层由离子储存层向电致变色层迁移
D.该装置可用于汽车的玻璃变色调光
【答案】C
【解析】
A.当a接外接电源负极时,电致变色层为阴极,发生电极反应WO3+Li++e-===LiWO3,LiWO3为蓝色晶体,b极接正极,离子储存层为阳极,发生电极反应Li4Fe4[Fe(CN)6]3-4e-===Fe4[Fe(CN)6]3+4Li+,Fe4[Fe(CN)6]3为蓝色晶体,蓝色与无色相比,可减小光的透过率,A选项正确;
B.当b接外接电源负极时,离子储存层为阴极,发生的电极反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3,B选项正确;
C.切换电源正负极使得蓝色变为无色时,即LiWO3变为WO3,Fe4[Fe(CN)6]3变为Li4Fe4[Fe(CN)6]3,电致变色层为阳极,离子储存层为阴极,则Li+通过离子导体层由电致变色层移向离子储存层,C选项错误;
D.该装置可实现变色,可用于汽车的玻璃变色调光,D选项正确;
答案选C。

【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
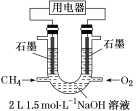
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。