题目内容
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用图所示装置进行实验(夹持仪器已略去,气密性已检验)。
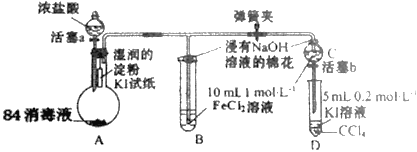
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C 中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B 中溶液红色加深,关闭活塞a。
Ⅳ……
(1)盛浓盐酸溶液的仪器名称是__;A中产生黄绿色气体,写出A中发生反应的离子方程式__。
(2)验证氯气的氧化性强于碘单质的实验现象是__。
(3)B中溶液发生的离子方程式__。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是__,对应反应的离子方程式是__。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
【答案】分液漏斗 ClO-+Cl-+2H+=Cl2↑+H2O 润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Cl-+2Fe3+ 打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡 静置后CCl4层溶液变为紫色 吸收氯气等有毒气体,防止污染空气 确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰
【解析】
A中发生反应2H++Cl-+ClO-=Cl2↑+H2O制取氯气,氯气使淀粉KI试纸变蓝;B中发生反应Cl2+2Fe2+=2Fe3++2Cl-溶液变为黄色,打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡。静置后CCl4层溶液变为紫色,发生反应2I-+2Fe3+=2Fe2++I2。浸有NaOH的棉花作用是吸收氯气等有毒气体,防止污染空气,过程Ⅲ需要确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰。
(1)由图可知,盛浓盐酸溶液的仪器名称是:分液漏斗;84消毒液的有效成分为NaClO,向84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O;
(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI试纸变蓝,发生反应的化学方程式为Cl2+2KI=2KCl+I2;
(3)B中的溶液变为黄色,B中反应为Cl2将Fe2+氧化成Fe3+,B中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;
(4)要验证Fe3+的氧化性强于I2,依据的反应原理为2Fe3++2I-=I2+2Fe2+,过程II的C中溶液变为黄色说明C中FeCl2被氧化成FeCl3,所以验证Fe3+的氧化性强于I2,过程IV的操作是:打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡;实验现象是:静置后CCl4层溶液变为紫色。反应的离子方程式为2Fe3++2I-=I2+2Fe2+;
(5)由于Cl2有毒,污染大气,浸有NaOH溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气;
(6)由于氯气也能将KI氧化成I2,要验证Fe3+的氧化性强于I2必须排除Cl2的干扰,即必须确认C的黄色溶液中无Cl2。过程III向B中加入一定量KSCN溶液,混合液呈红色说明B中FeCl2被氧化成FeCl3;一段时间后B中红色加深说明过程II的B中FeCl2未被完全氧化,则过程II的C中FeCl2未被完全氧化、黄色溶液中没有Cl2;过程III的实验目的是:确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的![]() 质量进行计算.某同学设计的实验装置示意图如下:
质量进行计算.某同学设计的实验装置示意图如下:

请回答:
(1)A中发生反应的化学方程式是__________________________。
(2)装置B中冰水的作用是_________________________。
(3)该同学设计的实验装置存在缺陷,改进后该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是________________(填字母)。
A.样品分解不完全
B.产生![]() 的速率太快,没有被碱石灰完全吸收
的速率太快,没有被碱石灰完全吸收
C.反应完全后停止加热,通入过量的空气.
(4)若C中的碱石灰改用足量![]() 固体,请设计实验方案检验反应后C中固体的成分___________。
固体,请设计实验方案检验反应后C中固体的成分___________。
(5)检验样品中是否还含有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
①_______________________________ | ②_________________ | 样品中含NaHCO3 |