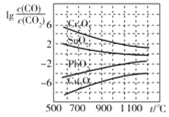
题目内容
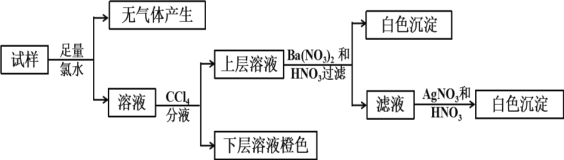
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
【答案】A
【解析】
无色溶液中一定不含Fe3+,该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,无SO42-;加足量氯水,无气体,无CO32-,溶液加四氯化碳分液,下层橙色,则有Br-,上层加硝酸钡和稀硝酸有白色沉淀,有SO32-,无Ba2+,溶液中一定含阳离子,且离子浓度都为0.1molL-1,根据电荷守恒,一定含有NH4+、Na+、K+,一定不存在Cl-,滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离子,结合溶液为电中性来解答。
A. 分析可知,肯定不存在的离子:Ba2+、Fe3+、SO42-、CO32-,一定含:NH4+、Na+、K+,A正确;
B. 原溶液肯定不含SO42-,但含有SO32-,B错误;
C. 加入Ba(NO3)2和HNO3溶液目的是检验硫酸根离子,若改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,C错误;
D. 根据电荷守恒,一定含有NH4+,D错误;故答案为:A。

【题目】某酸性工业废水中含有![]() ,光照下,草酸
,光照下,草酸![]() 能将其中的
能将其中的![]() 转化为
转化为![]() 某课题组研究发现,少量铁明矾
某课题组研究发现,少量铁明矾![]() 即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
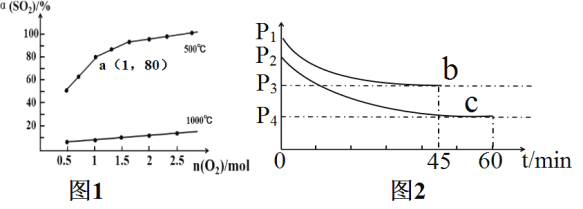
探究如下:在![]() 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
实验编号 | 初始pH | 废水样品体积 | 草酸溶液体积 | 蒸馏水体积 |
| 4 | 60 | 10 | 30 |
| 5 | 60 | 10 | 30 |
| 5 | 60 | 15 | 25 |
测得实验![]() 和
和![]() 溶液中的
溶液中的![]() 随时间变化关系如图所示.
随时间变化关系如图所示.
(1)实验![]() 和
和![]() 的结果表明 ______ .
的结果表明 ______ .
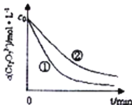
(2)根据实验![]() 和
和![]() ,画出实验
,画出实验![]() 中
中![]() 随时间变化的趋势图._____________
随时间变化的趋势图._____________
(3)该课题组对铁明矾![]() 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:![]() 起催化作用;
起催化作用;
假设二: ______ ;
假设三: ______ ;
![]()
(4)设计实验验证上述假设一,可选用下列物质代替少量铁明矾![]()
的是 ______ ![]()
![]()
![]() ,
,![]()
![]()