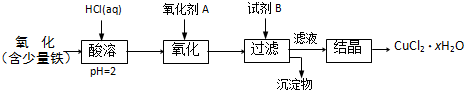
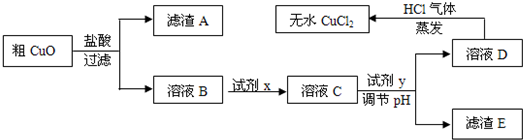
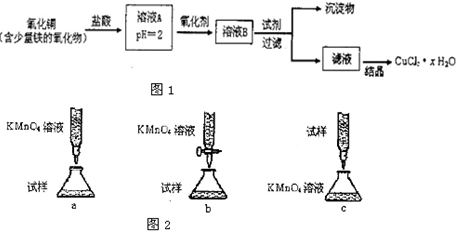
题目内容
制取无水CuCl2的装置图如图所示: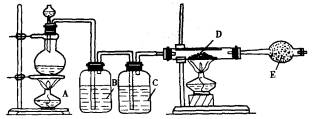
可供选择的试剂有:①固体NaCl ②NaCl饱和溶液 ③稀HCl ④浓H2SO4 ⑤稀H2SO4 ⑥MnO2 ⑦KMnO4
(1)图中A处分液漏斗中盛放的物质是__________,烧瓶中盛放的物质是__________.烧瓶中发生反应的化学方程式____________________.
(2)B中溶液是__________,C中溶液是__________,E中的试剂应是__________(自己另外选择),作用是______________________.
(3)开始时应首先点燃________处的酒精灯.
(4)反应后D中的固体呈________色,取少量溶于少量水中,溶液呈________色.
答案:
解析:
解析:
| (1)④,①⑥,2NaCl+3H2SO4(浓)+MnO2 (2)饱和NaCl溶液,浓H2SO4,碱石灰,①吸收未反应的Cl2,防止大气污染,②防止空气中的H2O(g)进入D管中 (3)A (4)棕黄,绿
|

练习册系列答案
相关题目
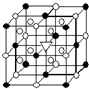 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子