题目内容
在20℃时,冰醋酸的密度为![]() ,计算冰醋酸的浓度.若实验测知1.0mol/L
,计算冰醋酸的浓度.若实验测知1.0mol/L
![]() 溶液的导电性最强,试分析冰醋酸稀释中氢离子浓度的变化规律.
溶液的导电性最强,试分析冰醋酸稀释中氢离子浓度的变化规律.
答案:
解析:
解析:
|
冰醋酸是不含水的纯净乙酸,是弱电解质,在无水存在情况下不能导电,其浓度可依据1L冰醋酸中所含 解答:冰醋酸的浓度为:
在20℃时冰醋酸为液态弱电解质,不能电离,因此
|

练习册系列答案
相关题目
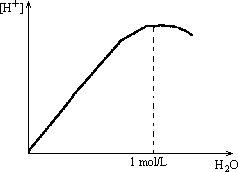
 CH3COO-+H+
ΔH>0。
CH3COO-+H+
ΔH>0。