题目内容
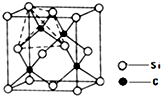
金刚砂(SiC)与金刚石具有相似的晶体结构(如图所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答

(1)金刚砂属于____晶体,金刚砂的熔点比金刚石的熔点____。
(2)在金刚砂的结构中,一个硅原子周围结合了______个碳原子,其中的键角是____。
(3)金刚砂的结构中含有共价键形成的原子环,其中最小的环上有____个硅原子。
(2)在金刚砂的结构中,一个硅原子周围结合了______个碳原子,其中的键角是____。
(3)金刚砂的结构中含有共价键形成的原子环,其中最小的环上有____个硅原子。
(1)原子;低
(2)4;109°28'
(3)3
(2)4;109°28'
(3)3

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 或
或
 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质] (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
