题目内容
13.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) $?_{充电}^{放电}$2PbSO4(s)+2H2O(l)市场上一种手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将浓硫酸灌注到硅胶凝胶中去,改善了电池的性能.下列说法不正确的是( )| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
分析 由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,结合电极方程式解答该题.
解答 解:A、放电时,电子由负极Pb通过外电路转移到正极PbO2,故A正确;
B、充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,故B正确;
C、充电时,电源的正极接蓄电池标“+”的一极,做电解池阳极,原电池中的负极铅连接标有“-”一极做电解池阴极,则电源的正极接铅蓄电池标“+”的一极,故C错误.
D、“无液干粉”铅酸蓄电池,无液体电解质所以不易发生泄漏,故D正确;
故选:C.
点评 本题考查学生二次电池铅蓄电池的工作原理知识,属于综合原电池和电解池工作原理知识的考查,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
3.下列基本实验操作中,不合理的是( )
| A. | 分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁 | |
| B. | 可用湿润的pH试纸检验氨气 | |
| C. | 稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水 | |
| D. | 试管可用酒精灯直接加热,也可用水浴加热 |
4.在实验室中,下列除杂的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通H2在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓H2SO4和浓HNO3,将其倒入NaOH溶液中,静置,分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶 |
1.元素R的气态氢化物化学式为H2R,下列叙述不正确的是( )
| A. | 该元素的原子最外层上有6个电子 | |
| B. | 该元素最高价氧化物的化学式为RO2 | |
| C. | 该元素是非金属元素 | |
| D. | 该元素最高价含氧酸的化学式为H2RO4 |
18.由两种元素组成的化合物M有如下转化关系:
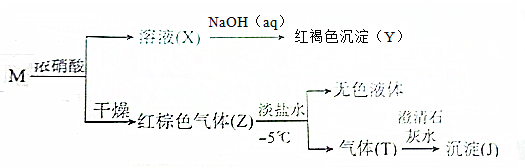
下列推断正确的是( )

下列推断正确的是( )
| A. | M可能是FeS2、Fe3C、CuS、和Fe3O4 | B. | Y可能是Fe(OH)3、Fe2O3 、Cu2O | ||
| C. | X溶液能溶解铁、铜等金属 | D. | 无色液体可能是N2O4和H2O |
5.除去下列物质括号中的杂质,所采用方法不正确的是( )
| A. | 淀粉(氯化钠)渗析 | |
| B. | 硬脂酸钠(甘油溶液)盐析、过滤 | |
| C. | 水(鸡蛋清)蒸馏 | |
| D. | 蔗糖(葡萄糖)与银氨溶液混合水浴加热,过滤 |
2.下列金属冶炼的反应原理,不正确的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
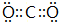 ,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.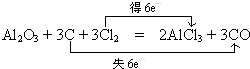 .
.