题目内容
9.工业制硫酸时,将SO2转化为SO3是一个关键的步骤.
(1)某温度,SO2(g)+1/2O2(g)?SO3(g)△H=-98kJ•mol-1.开始时在100L的密闭容器中加4.0mol SO2(g)和10.0mol O2(g),当达到平衡时共放出热量196kJ,该温度下平衡常数K=_3.33
(2)某人设想以如图1所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:SO2+2H2O-2e-=SO42-+4H+.
(3)常温,BaSO4的Ksp=1.08×10-10.将等体积的BaCl2溶液与2.0×10-3 mol•L-1的Na2SO4溶液混合.若要生成BaSO4沉淀,BaCl2溶液的最小浓度2.16×10-7mol/L.
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示.若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25mol•L-1).请在图2中画出此变化过程中SO3(G)浓度的变化曲线.
分析 (1)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(2)原电池负极发生氧化反应,SO2被氧化生成SO42-;
(3)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)•c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半;
(4)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化,和平衡浓度画出变化图象.
解答 解:(1)SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98kJ•mol-1,在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,则消耗SO2 2mol,
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98kJ•mol-1,
起始 4.0mol 10.0mol 0
转化 2.0mol 1.0mol 2mol
平衡 2.0mol 9.0mol 2mol
则平衡时:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L,
所以k=$\frac{0.02}{0.02×\sqrt{0.09}}$=3.33,
故答案为:3.33;
(2)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸,电极反应为:SO2+2H2O-2e-=SO42-+4H+;故答案为:SO2+2H2O-2e-=SO42-+4H+;
(3)等体积混合后,c(SO42-)=$\frac{1}{2}$×2.0×10-3mol/L=1.0×10-3mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=$\frac{1.08×10{\;}^{-10}}{10{\;}^{-3}}$mol/L=1.08×10-7mol/L,故原BaCl2溶液的浓度为2×1.08×10-7mol/L=2.16×10-7mol/L,
故答案为:2.16×10-7mol/L;
(4)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化和平衡浓度画出变化图象为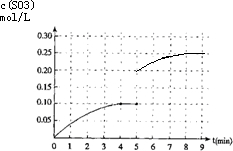 ,故答案为:
,故答案为: .
.
点评 本题考查了化学平衡常数的有关计算、影响化学平衡的因素、平衡图象、原电池等,题目难度中等,试题是对学生综合能力的考查,注意基础知识的理解掌握.

| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | 热的纯碱溶液用于清洗油污 | |
| C. | 次氯酸钠常用作消毒剂 | |
| D. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
| A. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:是否有电子的转移) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:能否产生丁达尔效应) | |
| C. | 纯净物分为:单质、化合物(标准:组成物质的元素种数) | |
| D. | 化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电的化合物) |
| A. | 所得到的分散系属于胶体 | |
| B. | 用一束光照射该分散系时,看不到一条光亮的“通路” | |
| C. | 该分散系不能透过滤纸 | |
| D. | 该分散系的分散质为Fe(OH)3 |
| A. | 用玻璃棒蘸取某种浓度的NaOH溶液点在湿润的pH试纸上测该溶液的pH值 | |
| B. | 用加热蒸发溶剂的方法可以由10%稀盐酸获得的20%浓盐酸 | |
| C. | 向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫色,说明可用CCl4从碘水中萃取碘 | |
| D. | 做蒸馏实验时,为节约用水,应先点燃酒精灯加热再通冷却水 |
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |

| A. | C20H12 | B. | C20H34 | C. | C22H12 | D. | C30H36 |