题目内容
16. 图为浓硫酸与铜片反应的装置.请回答:
图为浓硫酸与铜片反应的装置.请回答:(1)浓硫酸与铜片反应的方程式为Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应过程中,甲中的现象是产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体.
(3)下列说法中,不正确的是AC.
A.该反应中浓硫酸表现酸性、氧化性、吸水性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.含0.02mol溶质的浓硫酸与足量的铜片反应,能收集到224mL的SO2(标准状况)
D.反应一段时间后,将水缓慢倒入试管甲中,溶液显蓝色.
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)反应过程中,甲中产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体;
(3)A.该反应中浓硫酸只体现酸性和氧化性;
B.试管乙中含有碱液的棉花,防止二氧化硫散失到空气中,造成大气污染;
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,含有铜离子的溶液,溶液显蓝色;
D.含0.04mol溶质的浓硫酸与足量的铜片反应,随着反应的进行浓度减小,稀硫酸与铜不反应Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)反应过程中,甲中发生反应为Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体,
故答案为:产生无色气泡,铜片表面变黑,逐渐溶解;试管底部出现白色固体;
(3)A.该反应中浓硫酸只体现酸性和氧化性,故A错误;
B.试管乙中含有碱液的棉花,防止二氧化硫散失到空气中,造成大气污染,其作用是吸收过量的SO2,防止环境污染,故B正确;
C.含0.02mol溶质的浓硫酸与足量的铜片反应,随着反应的进行浓度减小,稀硫酸与铜不反应,所以收集到SO2的体积在标准状况小于224mL,故C错误;
D.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,含有铜离子的溶液,溶液显蓝色,故D正确;
故选:AC.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性是暂时的,加热时会恢复原来的颜色.

| A. | 氯化钠 | B. | 蔗糖 | C. | SO3 | D. | 稀硫酸 |
| A. | Al2O3 | B. | H2SO4 | C. | KClO3 | D. | NaHSO4 |
 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
| A. | SiO2的用途广泛,主要用途是用于做半导体材料 | |
| B. | SiO2不与任何酸或碱性性氧化物反应 | |
| C. | SiO2和CO2的结构不同,但它们都具有氧化性,都能与强碱反应 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
| A. | 在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 | |
| B. | 电解质越弱,则其溶液的导电能力就越差 | |
| C. | 在白色ZnS沉淀上滴CuSO4溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小 | |
| D. | 加热NaR溶液时,溶液的pH变小,证明HR为弱酸 |

 ,其空间构型平面形.
,其空间构型平面形.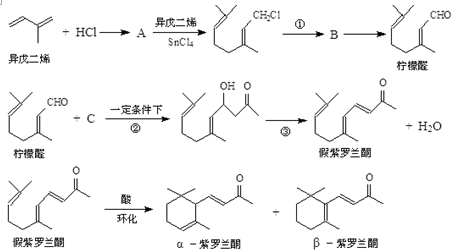
 +Cl2$\stackrel{1,4加成}{→}$
+Cl2$\stackrel{1,4加成}{→}$
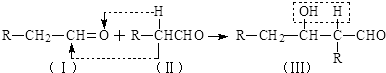
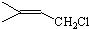 ,C的结构简式
,C的结构简式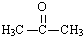 .
.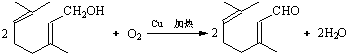 .
.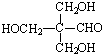 .
.