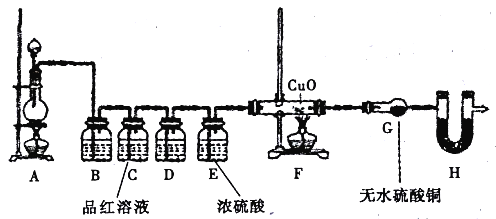
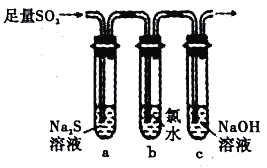
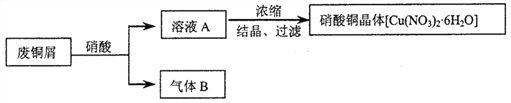
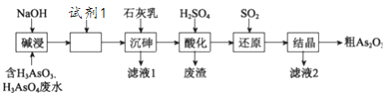
题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
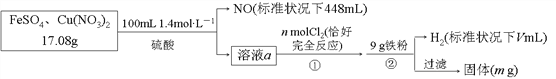
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
【答案】B
【解析】步骤②加入9g铁粉生成氢气,说明前面步骤硫酸有剩余,溶液a与nmol氯气完全反应,说明溶液a中含有Fe2+,17.08g FeSO4和Cu(NO3)2的混合物与0.14mol硫酸混合,NO3-全部被还原为NO,NO的物质的量是![]() ,根据氮元素守恒,样品中Cu(NO3)2的质量是
,根据氮元素守恒,样品中Cu(NO3)2的质量是![]() ,FeSO4的质量为17.08-1.88=15.2g; 物质的量是0.1mol;
,FeSO4的质量为17.08-1.88=15.2g; 物质的量是0.1mol;
设与硝酸根离子反应的亚铁离子的物质的量是xmol,消耗氢离子的物质的量为ymol;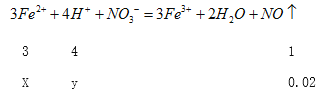
X =0.06,y=0.08mol;
溶液a中亚铁离子的物质的量是0.1-0.06=0.04mol;根据方程式![]() ,需要氯气0.02mol,故A正确;根据铁元素守恒,通入氯气后溶液中铁离子的物质的量是0.1mol,根据反应
,需要氯气0.02mol,故A正确;根据铁元素守恒,通入氯气后溶液中铁离子的物质的量是0.1mol,根据反应![]() ,消耗铁的物质的量是0.05mol,即2.8g;溶液a中氢离子的物质的量0.14
,消耗铁的物质的量是0.05mol,即2.8g;溶液a中氢离子的物质的量0.14![]() -0.08=0.2mol,根据
-0.08=0.2mol,根据![]() ,消耗铁0.1mol,即5.6g;a溶液中含有0.01mol
,消耗铁0.1mol,即5.6g;a溶液中含有0.01mol![]() ,消耗铁0.01mol,即0.56g;同时生成铜0.64g,剩余固体质量是9-2.8-5.6-0.56+0.64=0.68g,故B错误;生成氢气0.1mol,体积为2.24L,故C正确;原混合物中FeSO4的质量分数约为
,消耗铁0.01mol,即0.56g;同时生成铜0.64g,剩余固体质量是9-2.8-5.6-0.56+0.64=0.68g,故B错误;生成氢气0.1mol,体积为2.24L,故C正确;原混合物中FeSO4的质量分数约为![]() ,故D正确。
,故D正确。

练习册系列答案
相关题目