题目内容
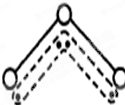 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V形,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V形,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)选出下列分子与O3分子的结构最相似的是
C
C
.A H2O B CO2 C SO2 D BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤电子对,那么O3分子有
5
5
对孤对电子.(3)O3与O2间的转化是否为氧化还原反应
否
否
(若否,请回答A小题;若是,请回答B小题)A O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
1
1
PbS+4
4
O3--1
1
PbSO4+4
4
O2B O3在催化剂作用下生成1molO2转移电子数
2
2
mol.分析:(1)O3分子与SO2分子为等电子体,结构相似;
(2)由结构可知,未参与成键的电子对为孤对电子;
(3)O3与O2间的转化,没有元素的化合价变化;
PbS+O3--PbSO4+O2中,S元素的化合价由-2价升高为+6价,O元素的化合价由0降低为-2价;
由反应中转移的电子计算.
(2)由结构可知,未参与成键的电子对为孤对电子;
(3)O3与O2间的转化,没有元素的化合价变化;
PbS+O3--PbSO4+O2中,S元素的化合价由-2价升高为+6价,O元素的化合价由0降低为-2价;
由反应中转移的电子计算.
解答:解:(1)O3分子与SO2分子为等电子体,结构相似,而与其它选项结构不同,水为V型,但夹角不同,故答案物:C;
(2)由结构可知,未参与成键的电子对为孤对电子,共有5对,故答案为:5;
(3)O3与O2间的转化,没有元素的化合价变化,则不属于氧化还原反应;
PbS+O3--PbSO4+O2中,S元素的化合价由-2价升高为+6价,O元素的化合价由0降低为-2价,则由电子守恒可知反应为PbS+4O3=PbSO4+4O2,由反应中可知,生成4molO2转移电子8mol,则1molO2转移电子为2mol,
故答案为:否;1;4;1;4;2.
(2)由结构可知,未参与成键的电子对为孤对电子,共有5对,故答案为:5;
(3)O3与O2间的转化,没有元素的化合价变化,则不属于氧化还原反应;
PbS+O3--PbSO4+O2中,S元素的化合价由-2价升高为+6价,O元素的化合价由0降低为-2价,则由电子守恒可知反应为PbS+4O3=PbSO4+4O2,由反应中可知,生成4molO2转移电子8mol,则1molO2转移电子为2mol,
故答案为:否;1;4;1;4;2.
点评:本题考查氧化还原反应,侧重等电子体、氧化还原反应的配平及计算性的考查,注意元素的价态变化即可解答,题目难度不大.

练习册系列答案
相关题目