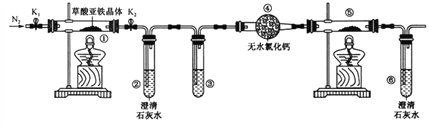
��Ŀ����
����Ŀ��A��B��C��DΪ������Ԫ�أ��˵��������������A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5����֪A��ԭ�ӽṹ���Ԫ�أ�BԪ��ԭ��������ϵĵ�����������Ӳ�����2����A��C֮����γ�A2C��A2C2���ֻ����D��ͬ��������Ԫ����ԭ�Ӱ뾶�����ش��������⡣
(1)CԪ����Ԫ�����ڱ��е�λ����____________��C��D����Ԫ�����γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����________________��(�����ӷ��ű�ʾ)
(2)д��A2C2�ĵ���ʽ__________��
(3)�ں����£����Ϊ2 L�ĺ��������м���һ������B���ʺ�1 mol A2C������������B(s)��A2C(g) BC(g)��A2(g)��2 min��������ѹǿ������20%����2 min��A2C�ķ�Ӧ����Ϊ________��һ��ʱ���ﵽƽ�⣬����˵����ȷ����__________��
A.����B���ʵ�������Ӧ���ʼӿ�
B.���º���ʱ�ڸ�������ͨ��Ar����Ӧ���ʼӿ�
C.������ܶȲ��ٱ仯�����жϸ÷�Ӧ�ﵽ��ƽ��
D.2 minʱ��A2C��ת����Ϊ80%
E.�����ƽ��Ħ����������ʱ���÷�Ӧ�ﵽƽ��
(4)BC��C2��DCA��Һ�п��γ�һ��ȼ�ϵ�ء��õ�صĸ�����ӦʽΪ��___________��
(5)��0.2 mol D2C2Ͷ�뵽����0.1 mol FeCl2��ˮ��Һ��ǡ�ó�ַ�Ӧ����Ӧ���ܻ�ѧ����ʽΪ��______________________________________________��
���𰸡� �ڶ�����VIA�� O2��>Na�� ![]() 0.05 mol/(L��min) CE CO��4OH����2e��==CO32-��2H2O 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
0.05 mol/(L��min) CE CO��4OH����2e��==CO32-��2H2O 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
��������A��B��C��DΪ������Ԫ��,�˵������������,A��ԭ�ӽṹ���Ԫ��,��AΪ��,���ڵ�һ����,A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5,��B��Cֻ�ܴ��ڵڶ�����,BԪ��ԭ��������ϵĵ�����������Ӳ�����2��,����������Ϊ4,��BΪ̼Ԫ��,A��C֮����γ�A2C��A2C2���ֻ�����,��CΪ��Ԫ��;D��ͬ��������Ԫ����ԭ�Ӱ뾶���,����IA��,ԭ������������,��DΪNa��
(1)�������Ϸ�����CΪ��Ԫ��,��Ԫ�����ڱ��е�λ���ǵڶ����ڵ�VIA��, C��D����Ԫ�����γɵļ����ӷֱ�ΪO2����Na��,���ߵ��Ӳ�ṹ��ͬ,�˵����Խ�����Ӱ뾶ԽС,�����Ӱ뾶�ɴ�С��˳����: O2����Na��,
��ˣ�������ȷ����:�ڶ����ڵ�VIA����O2����Na����
(2)H2O2�ĵ���ʽΪ![]()
��ˣ�������ȷ������![]() ��
��
(3)��ת����ˮ�����ʵ���Ϊamol,��
C(s)��H2O(g) CO(g)��H2(g)
��ʼ(mol) 1 0 0
ת��(mol) a a a
ƽ��(mol) 1-a a a
2min��������ѹǿ������20%����1mol![]() (1+20%)=1+a,��a=0.2,��2min��H2O�ķ�Ӧ����Ϊ
(1+20%)=1+a,��a=0.2,��2min��H2O�ķ�Ӧ����Ϊ![]() =0.05 mol/(L��min)��
=0.05 mol/(L��min)��
A.���ӹ��嵥�ʵ���,����Ӱ�컯ѧ��Ӧ����,��A������
B.���º���ʱ�ڸ�������ͨ��Ar,���ı䷴Ӧ�и������ʵ�Ũ��,�ʻ�ѧ��Ӧ���ʲ���,��B������
C.�淴Ӧ������,����������������,�����������,��������ܶ�����,�ܶȲ��ٱ仯�����жϸ÷�Ӧ�ﵽ��ƽ��,����Cѡ������ȷ����
D.2 minʱ��H2O��ת����Ϊ![]() 100%=20%����D������
100%=20%����D������
E.1molˮ��Ӧ�õ�1mol��1mol����,�������ƽ����Է�������Ϊ15,�ʻ��������ƽ����Է���������С,ƽ����Է�����������˵������ƽ������E��ȷ��
��ˣ�������ȷ������0.05 mol/(L��min)��CE��
(4)COȼ�����ɶ�����̼,������̼��Ӧ����̼���,��������������Ӧ,��ȼ�ϵ�صĸ�����ӦΪ��CO��4OH����2e��==CO32-��2H2O,
��ˣ�������ȷ������CO��4OH����2e��==CO32-��2H2O��
(5) ��0.2 mol D2C2Ͷ�뵽����0.1 mol FeCl2��ˮ��Һ��ǡ�ó�ַ�Ӧ���������Ʒ�Ӧ�õ�0.4molNaOH��0.1molO2��0.1molFeCl2��Ӧ����0.2molNaOH���õ�0.1molFe(OH)2��ʣ��0.2molNaOH��0.1molFe(OH)2ת��Ϊ0.1molFe(OH)3��������Ϊ![]() =0.025mol,��ʣ��0.075molO2,��Ӧ���ܵĻ�ѧ����ʽΪ: 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
=0.025mol,��ʣ��0.075molO2,��Ӧ���ܵĻ�ѧ����ʽΪ: 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
��ˣ�������ȷ������8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2����

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д�