题目内容
14.A、B、C、D、E是高中常见的化学物质,它们间的反应关系如图所示:
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,写出该反应的离子方程式Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3↑+2H2O.
(2)A是2:1型的离子化合物,B是正盐溶液,D既可溶于盐酸又可溶于NaOH溶液,且A与B以物质的量之比为3:1恰好完全反应,推知A、B的化学式为Na2O2、Al2(SO4)3.
分析 (1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,结合转化关系可知,C为氨气、D为硫酸钡,则A为氢氧化钡、B为硫酸铵,可推知E为水;
(2)D既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,说明A、B在溶液中反应生成OH-,而A是2:1型的离子化合物,应为Na2O2,与水反应生成氢氧化钠和氧气,
A与B以物质的量之比为3:1恰好完全反应,则B应为Al2(SO4)3,二者发生6Na2O2+2Al2(SO4)3+6H2O=3O2↑+4Al(OH)3↓+6Na2SO4,以此解答.
解答 解:(1)强碱与铵盐共热放氨气,因A为强碱,所以B为铵盐,根据D不溶于稀硝酸,所以D为硫酸钡,故B为硫酸铵,A为氢氧化钡,二者反应的离子方程式为:
Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3↑+2H2O,
故答案为:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3↑+2H2O;
(2)D既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,说明A、B在溶液中反应生成OH-,而A是2:1型的离子化合物,应为Na2O2,与水反应生成氢氧化钠和氧气,
A与B以物质的量之比为3:1恰好完全反应,则B应为Al2(SO4)3,二者发生6Na2O2+2Al2(SO4)3+6H2O=3O2↑+4Al(OH)3↓+6Na2SO4,
故答案为:Na2O2、Al2(SO4)3.
点评 本题考查无机物推断,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,需要学生熟练掌握元素化合物性质,属于猜测验证型题目,难度中等.

练习册系列答案
相关题目
12.有镁、铝混合粉末25.5克,将它完全溶于600ml 5mol/L的盐酸溶液中,若要使沉淀质量达到最大值,则需加入2mol/L的氢氧化钠溶液的体积为( )
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
2.下列说法正确的是( )
| A. | 自然界中含有大量游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | Si、P、S、Cl相应的氧化物对应水化物的酸性依次增强 | |
| C. | 工业上通常用电解熔融氧化铝制得金属铝 | |
| D. | 金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步发生 |
9.氯霉素是一种常见的药物,实验发现由于其分子结构中含有羟基而具有苦味.但如果将其分子中碳链末端的羟基中的氢原子换成来自棕榈酸中的原子团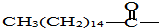 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
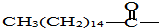 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 无味氯霉素的水溶性变差,所以苦味消失 | |
| B. | 无味氯霉素失去了药性,所以苦味消失 | |
| C. | 无味氯霉素是棕榈酸的盐类 | |
| D. | 无味氯霉素在人体内不会发生水解 |
19.25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) | |
| C. | NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
6.日本冈山大学教授滨田博喜和研究员富良德等通过实验发现,桉树叶子的培养细胞能够消除有害化学物质双酚A的毒性.双酚A的结构简式如图所示,下列有关此物质的说法正确的是( )
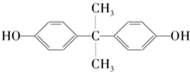

| A. | 1 mol该物质与足量溴水反应消耗2 mol Br2 | |
| B. | 该物质能与碳酸氢钠溶液反应放出CO2 | |
| C. | 该物质的所有碳原子可能在同一平面 | |
| D. | 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2 |
4.X、Y、Z、W是四种短周期元素,有关它们的信息如下表所示.
请回答下列问题:
(1)X的单质分子X2的结构式是S=S.
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
(3)常温时,W的硫酸盐溶液的pH<(填“=”、“>”或“<”)7,理由是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)25℃、101kPa时,32g Y的最简单气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的单质分子X2的结构式是S=S.
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
(3)常温时,W的硫酸盐溶液的pH<(填“=”、“>”或“<”)7,理由是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)25℃、101kPa时,32g Y的最简单气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
 .
.