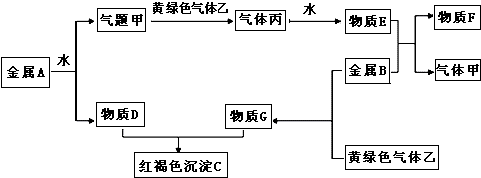
题目内容
(1)在①稀硫酸 ②液态HCl ③NaOH溶液 ④蔗糖晶体 ⑤Na3PO4固体⑥铜丝 ⑦液氨 ⑧酒精 ⑨熔融NaCl 上述状态下可导电的是 ;(填写序号,下同) 属于非电解质的是 ; 上述状态下的电解质不能导电的是 .
(2)写出下列物质水溶液的电离方程式:KHSO4 Ba(OH)2 .
(2)写出下列物质水溶液的电离方程式:KHSO4
考点:电离方程式的书写,电解质与非电解质
专题:
分析:(1)物质导电的条件:含有自由移动的电子或者离子;
电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
单质、混合物既不是电解质也不是非电解质;
(2)明确电解质的强弱,强电解质完全电离,用等号,弱电解质部分电离,用可逆号;
电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
单质、混合物既不是电解质也不是非电解质;
(2)明确电解质的强弱,强电解质完全电离,用等号,弱电解质部分电离,用可逆号;
解答:
解:(1)①稀硫酸③NaOH溶液 ⑨熔融NaCl 都含有自由移动的离子,能够导电;⑥铜丝属于金属,含有自由电子,能够导电;
④蔗糖晶体⑦液氨 ⑧酒精本身都不能电离,属于非电解质;
②液态HCl ⑤Na3PO4固体虽然是电解质,但是在给定状态下都不能电离,不含自由移动的离子,所以不导电;
故答案为:①③⑥⑨;④⑦⑧;②⑤;
(2)KHSO4属于盐,为强电解质,在水溶液中完全电离,电离方程式为:KHSO4=K++H++SO42-,
Ba(OH)2属于强碱,为强电解质,在水溶液 中完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-;
故答案为:KHSO4=K++H++SO42-,Ba(OH)2=Ba2++2OH-;
④蔗糖晶体⑦液氨 ⑧酒精本身都不能电离,属于非电解质;
②液态HCl ⑤Na3PO4固体虽然是电解质,但是在给定状态下都不能电离,不含自由移动的离子,所以不导电;
故答案为:①③⑥⑨;④⑦⑧;②⑤;
(2)KHSO4属于盐,为强电解质,在水溶液中完全电离,电离方程式为:KHSO4=K++H++SO42-,
Ba(OH)2属于强碱,为强电解质,在水溶液 中完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-;
故答案为:KHSO4=K++H++SO42-,Ba(OH)2=Ba2++2OH-;
点评:本题考查了电解质、非电解质的判断及电离方程式的书写,为高考频考点,明确相关概念的内涵是解题关键,注意书写电离方程式时必须明确电解质的强弱和电离的方式,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,物质之间不可能实现如下转化的是:X
Y
Z.( )
| M |
| M |
| 选 项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、硫酸和氯化钡溶液反应 Ba2++SO42-═BaSO4↓ |
| C、氢氧化钠和足量二氧化碳反应 2OH-+CO2═CO32-+H2O |
| D、铁钉放入硫酸铜溶液中 Fe+3Cu2+═2Fe3++3Cu |
在一恒容真空密闭容器,通入2molPCl3和2molCl2,加热到200℃时发生了反应:PCl5(g)?PCl3(g)+Cl2(g),达到平衡时,PCl5有0.4mol,如果此时移走1molPCl3和1molCl2,再次达到平衡时PCl5的物质的量是( )
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |



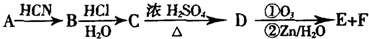
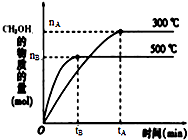 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.