题目内容
单质X与浓H2SO4共热,反应中X与H2SO4的物质的量之比为1:2,则X元素在生成物中的化合价可能为( )
①+1 ②+2 ③+3 ④+4.
①+1 ②+2 ③+3 ④+4.
分析:若X为金属,X与H2SO4反应生成硫酸盐、SO2、H2O,若X为非金属,X与H2SO4反应生成X的氧化物、SO2、H2O,根据电子转移守恒计算X元素在生成物中的化合价可能化合价.
解答:解:若X为金属,X与H2SO4反应生成硫酸盐、SO2、H2O,令X元素在生成物中的化合价为n,1molXn+离子与
mol硫酸根结合,则:
1mol×n=(2mol-
mol)×(6-4)
解得:n=+2,
若X为非金属,X与H2SO4反应生成X的氧化物、SO2、H2O,令X元素在生成物中的化合价为m,则:
1mol×m=2mol×(6-4)
解得:m=+4,
故选A.
| n |
| 2 |
1mol×n=(2mol-
| n |
| 2 |
解得:n=+2,
若X为非金属,X与H2SO4反应生成X的氧化物、SO2、H2O,令X元素在生成物中的化合价为m,则:
1mol×m=2mol×(6-4)
解得:m=+4,
故选A.
点评:本题考查氧化还原反应的有关计算,难度不大,讨论X为金属还是非金属是关键,再利用电子转移守恒计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
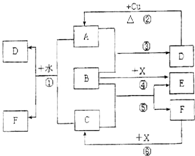 已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:


 +H2O
+H2O