题目内容
下列关于氯水的叙述,不正确的是
| A.新制氯水中只含有Cl2和H2O分子 |
| B.加入AgNO3溶液有白色沉淀产生 |
| C.光照氯水有气泡逸出,久置的氯水,酸性增强 |
| D.饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
A
解析试题分析:A、新制氯水含有Cl2分子、H2O分子、HClO分子,错误;B、氯水中含有Cl?,加入AgNO3溶液,有白色沉淀AgCl产生,正确;C、光照氯水时,HClO分解生成O2,有气泡逸出,久置的氯水逐渐转化为HCl,酸性增强,正确;D、饱和氯水存在平衡:Cl2+H2O  HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,正确。
HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,正确。
考点:本题考查氯水的成分和性质。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入BaCl2溶液,产生的沉淀为
| A.BaSO4 | B.BaSO3 | C.BaS | D.BaSO4和BaSO3 |
自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是
| A.NaNO3 | B.FeCl2 | C.Na2SO4 | D.AlCl3 |
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
| A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 |
| D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 |
由二氧化硅制高纯硅的流程如下,下列判断中错误的是
| A.①②③均属于氧化还原反应 | B.H2和HCl均可循环利用 |
| C.SiO2是一种坚硬难熔的固体 | D.SiHCl3摩尔质量为135.5g |
下列有关说法正确的是( )
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0 |
将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是:
| A.CO2 | B.NH3 | C.NO2 | D.H2S |
如图:A处通入氯气,关闭B阀时,C处湿润红色布条无变化,打开B阀时,C处湿润的红色布条褪色。则D中可以盛放足量的 ( )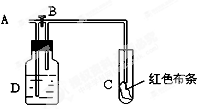
| A.浓硫酸 | B.氢氧化钠溶液 | C.水 | D.饱和食盐水 |
试管中充满某气体后倒立于盛水的水槽中,试管中立即充满液体,结果如图所示,该试管中原来所装的气体可能是( )
| A.CO2 | B.NO | C.NH3 | D.Cl2 |