题目内容
由二氧化硅制高纯硅的流程如下,下列判断中错误的是
| A.①②③均属于氧化还原反应 | B.H2和HCl均可循环利用 |
| C.SiO2是一种坚硬难熔的固体 | D.SiHCl3摩尔质量为135.5g |
D
解析试题分析:A.反应①为SiO2+2C=Si+2CO↑,反应②Si(粗)+3HCl=SiHCl3+H2,反应③SiHCl3+H2=Si(粗)+3HCl,三个方程式中元素的化合价均发生变化,均属于氧化还原反应,故A正确;B.生产高纯硅的流程示意图可知,H2和HCl既是反应物,又是生成物,所以可重复利用的物质是H2和HCl,故B正确;C.SiO2是原子晶体,硬度大、熔点高,故C正确;D.SiHCl3摩尔质量为135.5g/mol,故D错误;故选D.
考点:本题主要考查了氧化还原反应的判断、原子晶体的性质,摩尔质量的单位,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
在下列溶液中通入过量的CO2气体,最终一定有沉淀产生的组合是
①NaAlO2溶液 ②CaCl2溶液 ③NaOH溶液 ④澄清石灰水 ⑤饱和碳酸钠溶液
| A.①⑤ | B.①②⑤ | C.①②④ | D.①③④⑤ |
下列溶液中能够区别SO2和CO2气体的是
①澄清石灰水 ②KMnO4酸性溶液 ③氯水 ④品红溶液
| A.①③④ | B.②③④ | C.①②③ | D.全部 |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应,二者相比较,相等的是( )
| A.铜片完全消耗时所用的时间 | B.反应中转移的电子总数 |
| C.反应所消耗硝酸的物质的量 | D.反应生成气体的体积(标准状况) |
用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH ②AgNO3 ③Na2CO3 ④KI ⑤FeCl2
| A.只有②④ | B.只有④⑤ | C.只有②④⑤ | D.全部 |
下列关于氯水的叙述,不正确的是
| A.新制氯水中只含有Cl2和H2O分子 |
| B.加入AgNO3溶液有白色沉淀产生 |
| C.光照氯水有气泡逸出,久置的氯水,酸性增强 |
| D.饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
用图所示装置进行实验,下列对实验现象的解释不合理的是( )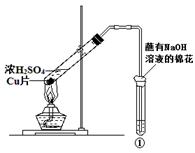
| | ①中试剂 | ①中现象 | 解 释 |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
下列说法正确的是( )
| A.1 mol Cl2参加反应转移电子数一定为2NA |
| B.在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3 mol Cl2转移电子数为6NA |
| C.SiO2与烧碱反应只生成盐和水,属于酸性氧化物 |
| D.Cl2的水溶液具有酸性,Cl2通入紫色石蕊溶液中,溶液只变红 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。若该气体为无色气体,且通过品红溶液后,品红溶液褪色,剩余气体与空气接触时,很快变为红棕色。下列判断正确的是
| A.肯定只有NO |
| B.肯定有SO2和O2 |
| C.可能有Cl2和O2 |
| D.肯定没有Cl2、O2和NO2 |