题目内容
四氯化锡是无色液体,熔点为-33℃,沸点114.1℃,遇潮湿空气便发生水解.又知,干燥的氯气跟熔化的金属锡(锡的熔点为231℃)反应,可制取无水四氯化锡,请用图中所示的仪器,设计组装一套制取无水四氯化锡的实验装置.
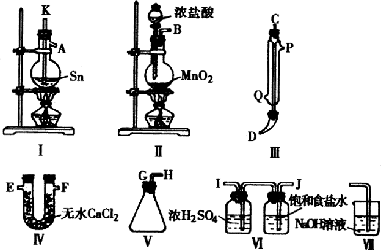
(1)用玻璃管或乳胶管连接上述装置,正确的连接顺序是:________接________,________接________,________接________,________接________,________接________.
(2)装置(Ⅵ)的作用是________装置(Ⅳ)的作用是________.
(3)冷凝管是冷却水的流向是从________流入,从________流出.
(4)实验时应先点燃________处酒精灯,加热温度应高于________,待________即可停止加热,其原因________.
(5)四氯化铝遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________.
(6)如果将制取的四氯化锡少许暴待于空气中,予期可看到的现象是________.
(7)为了防止污染空气,在装置的最后应该再接________.
解析:
|
解答:(1)B接J,I接K,A接C,D接G,H接E(或F). (2)除去 (3)冷凝水从Q进入,从P流出. (4)装置(Ⅰ)中,加热到231℃,锡粒熔化,此时才能通入干燥氯气; (5) (6)有白色的烟( (7)用盛有NaOH溶液的仪器(烧杯或锥形瓶)吸收氯气尾气,这个反应的化学方程式是:
详解:本题把氯气的制备、净化、干燥及其实验操作,氯气与熔化的金属锡反应制取四氯化锡,以及四氯化锡的收集和氯气尾气的吸收等联系在一起,增加了这道实验试题的难度和综合度. 在本题中制取的四氯化锡是大纲中没有的新物质,但是,在试题的题干中给出了有关信息,即“氯气和熔化状态的金属锡反应,可制得四氯化锡”,又给出“金属锡的熔点是231℃”“四氯化铝的沸点是141.1℃”,这就是说,要在装置(Ⅰ)中将锡加热到231℃,使锡熔化,然后将纯净、干燥的氯气通入(由K口进入)熔化的锡中,发生化合反应,生成无水的四氯化锡.由于 还有一点必须指出:金属锡(熔化)跟氯气的化合反应,是一个放热反应
这个反应放出的热量,可以使锡粒熔化,不需继续加热,也就是说,反应发生后,装置(Ⅰ)的酒精灯应该熄灭. |



