题目内容
3.下列有关实验的说法正确的是( )| 实验目的 | 实验方案 | |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 证明非金属性S>C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫和二氧化碳都能使澄清石灰水变浑浊;
B.在蛋白质溶液中加入硫酸钠溶液,发生盐析,不是变性;
C.水解后检验葡萄糖应在碱性溶液中;
D.利用最高价含氧酸的酸性比较非金属性的强弱.
解答 解:A.碳与浓硫酸在加热条件下反应生成二氧化硫和二氧化碳,如先通过澄清石灰水,则二则都能使石灰水变浑浊,不能证明,故A错误;
B.在蛋白质溶液中加入硫酸钠溶液,发生盐析,不是变性,故B错误;
C.水解后检验葡萄糖应在碱性溶液中,加入适量稀NaOH溶液再向其中加入新制的银氨溶液,并水浴加热,可证明,故C正确;
D.测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大,则碳酸酸性小于亚硫酸,但亚硫酸不是最高价含氧酸,不能比较非金属性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,侧重于基本实验的操作的考查,涉及物质的检验、蛋白质的性质和非金属性比较等问题,题目难度不大,注意把握相关基础知识.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
13.降解塑料  在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )
在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )
 在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )
在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )| A. | 降解塑料是一种高分子化合物 | B. | 其分子量为72n | ||
| C. | 经加聚反应生成 | D. | 其单体是CH3CH(OH)COOH |
14.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液于稀硫酸反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH -═Cl-+ClO-+H2O | |
| D. | 实验室中氯气的制取:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O |
11.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
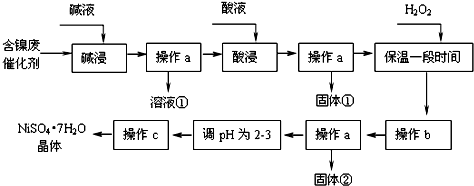
部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
18.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
18.居室装修用石材的放射性常用22688Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
| A. | RaCl2的分子量更大,熔沸点比CaCl2高 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra(OH)2是一种两性氢氧化物 | |
| D. | 一个22688Ra原子中含有138个中子 |
