题目内容
下列有关说法不正确的是( )
分析:A、催化剂改变反应历程,改变反应速率,但不影响化学平衡移动;
B、升高温度反应速率加快;
C、构成Cu-Zn-硫酸原电池,Cu片为正极,发生还原反应;
D、锌置换出Cu,构成原电池,加快反应速率.
B、升高温度反应速率加快;
C、构成Cu-Zn-硫酸原电池,Cu片为正极,发生还原反应;
D、锌置换出Cu,构成原电池,加快反应速率.
解答:解:A、使用催化剂加快反应速率,不能影响化学平衡的移动,即不能改变化学反应限度,故A错误;
B、升高温度,增大活化分子百分数,增大活化分子数目,化学反应速率加快,故B正确;
C、构成Cu-Zn-硫酸原电池,Cu片为正极,发生还原反应,氢离子在铜片上获得电子,生成氢气,故C正确;
D、锌置换出Cu,构成原电池,加快反应速率,故D正确;
故选A.
B、升高温度,增大活化分子百分数,增大活化分子数目,化学反应速率加快,故B正确;
C、构成Cu-Zn-硫酸原电池,Cu片为正极,发生还原反应,氢离子在铜片上获得电子,生成氢气,故C正确;
D、锌置换出Cu,构成原电池,加快反应速率,故D正确;
故选A.
点评:本题影响化学反应速率的影响因素、原电池原理等,难度不大,注意掌握外界条件对化学反应速率的影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )
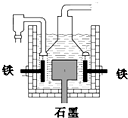
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-═Na | B、盖?吕萨克法制钠原理是熵的增加带动了反应的进行 | C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 | D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
 桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )
桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )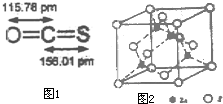 用于合成氨的工业煤气中含有S2H、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有S2H、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理. 电解氯化铜溶液时,实验测得其溶液的pH随时间的变化如图所示,下列有关说法不正确的是( )
电解氯化铜溶液时,实验测得其溶液的pH随时间的变化如图所示,下列有关说法不正确的是( )