题目内容
某温度下,C和水蒸气在密闭容器中发生下列反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为
[ ]
A.0.1mol/L
B.0.9mol/L
C.1.8mol/L
D.1.9mol/L
答案:B
解析:
解析:
|
【解析】此题考查的是连续反应的计算.要考虑到在连续反应中,一些物质会参与两个反应,如此题中的CO,H2O及H2,而且这两个反应都是可逆反应,CO作为第一个反应的生成物,在第二个反应中作为反应物是不会消耗完的,一定还会有剩余.可设第一个反应中生成的CO物质的量为x,第二个反应中消耗的CO物质的量为y,则 C(s)+H2O(g) x x CO(g)+H2O(g) y y 反应达到平衡时,c(H2)=x+y=1.9mol/L,c(CO)=x-y=0.1mol/L,解得x=1mol/L,y=0.9mol/L,所以c(CO2)=y=0.9mol/L. |

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
 CO(g)+H2(g),
CO(g)+H2(g), CO2(g)+H2(g)
CO2(g)+H2(g) 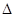 H=-41.16kJ/mol,对于该反应有关表述正确的是 。
H=-41.16kJ/mol,对于该反应有关表述正确的是 。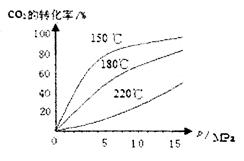
 CO2(g)+H2(g)
CO2(g)+H2(g)  H=-41.16kJ/mol,对于该反应有关表述正确的是
。
H=-41.16kJ/mol,对于该反应有关表述正确的是
。