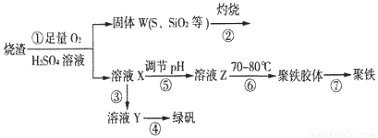
题目内容
取含SiO2和FeS2的矿石样品1g,在O2中充分灼烧后,残余固体质量是0.84g,用1000t这样的矿石可制得多少吨质量分数98%的H2SO4?(设生产中S的损失为2%,反应方程式为:4FeS2+11O2
答案:
解析:
解析:
| 解:设1g矿样品中含FeS2的质量为x,SiO2为(1g-x)。
2FeS2→Fe2O3 240 160 x
x=0.48g w(FeS 设生产质量分数98%的H2SO4的质量为y。 FeS2 → 2H2SO4 120 196 1000t´48%´(1-2%) y´98% y=
|

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
| |||||||||||||||||||||||||||||||