题目内容
20.依据元素周期表及元素周期律,下列推断正确的是( )| A. | 同一周期元素的原子,半径越小电负性越大 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M | |
| D. | 主族元素的最高正化合价等于该元素原子的最外层电子数 |
分析 A.同一周期原子半径越小,原子核对电子的吸引越强,原子越容易获得电子;
B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强;
C.M+和R2-的核外电子层结构相同,M处于R的下一周期;
D.主族元素的最高正化合价等于该元素原子的最外层电子数等于主族族序数.
解答 解:A.同一周期原子半径越小,原子核对电子的吸引越强,原子越容易获得电子,故A错误;
B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,不同周期金属性不一定,如金属性Ca>Na,故B错误;
C.M+和R2-的核外电子层结构相同,M处于R的下一周期,原子序数:M>R,故C错误;
D.主族元素的最高正化合价等于该元素原子的最外层电子数,故D正确;故选D.
点评 本题考查结构性质位置关系,比较基础,注意基础知识的理解掌握.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
10.电解硫酸铜溶液一段时间后,停止电解.往溶液中加入1mol Cu(OH)2和3mol水,可以使溶液恢复到电解前的成分和浓度,则在电解过程中,电子转移( )mol.
| A. | 10 | B. | 6 | ||
| C. | 2 | D. | 不可能出现此情况 |
11.下列各组离子能在溶液中大量共存,且溶液呈碱性、透明的是( )
| A. | AlO2-、K+、CO32-、Na+ | B. | Na+、OH-、H2PO4-、NO3- | ||
| C. | Al3+、Cl-、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
5.用如图所示装置及药品进行相应实验,能达到实验目的是( )


| A. | 图1(分离乙醇和乙酸) | B. | 图2(除去乙炔中的乙烯) | ||
| C. | 图3(除去溴苯中的溴单质) | D. | 图4(除去工业酒精中的甲醇) |
12.下列化学实验操作或事故处理方法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| C. | 酒精灯着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
9.醋酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol•L-1的醋酸溶液中c(H+)=0.01mol•L-1 | |
| B. | 醋酸以任意比与H2O互溶 | |
| C. | 10mL 1mol•L-1的醋酸溶液恰好与10mL 1mol•L-1的NaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸弱 |
10.某种药物合成中间体结构简式为: ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
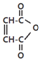 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径:
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径: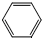 而不是
而不是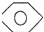 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 或
或 .
.