题目内容
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量.
(1)写出肼和过氧化氢的电子式:肼________,过氧化氢________.
(2)写出热化学方程式________.
(3)已知H2O(l)=H2O(g),△H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________.
(4)上述反应应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是________.
答案:
解析:
解析:
|
(1) (2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.625KJ/mol (3)408.8kJ (4)生成N2和H2O,对环境无污染. |

练习册系列答案
相关题目
 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:

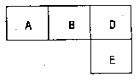 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答: