题目内容
|
在下列转变中需要加入还原剂的是 | |
A. |
Fe3+→Fe2+ |
B. |
Cl-→Cl2 |
C. |
Mg(OH)2→MgO |
D. |
|
解析:
|
需要加入还原剂,那么该物质要被还原,化合价要降低,所以A、D两项符合题意. |

(08山东省淄博模拟)(18分)在用FeSO4溶液与NaOH溶液反应制备白色的Fe(OH)2时,出现了“白色沉淀迅速转变为灰绿色,最后逐渐变成红褐色”的实验现象,如何解释出现灰绿色的现象,探究小组的同学产生了不同的观点:
①灰绿色物质就是红褐色的氢氧化铁跟白色的氢氧化亚铁的简单混合物;
②灰绿色物质是铁的一种新的氢氧化物,但其中不含Fe3+离子。
(1)验证观点①不正确的实验操作是: ,
验证观点②所需的试剂有: 。
(2)某同学查阅资料后,得到Fe(OH)2如下信息:

阅读该资料后,你对上述实验中出现灰绿色的现象的解释是:__________。
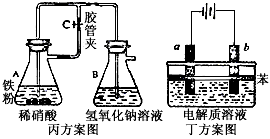
探究小组的同学在研究由Fe2+制备Fe(OH)2的过程中,甲、乙、丙、丁四位同学分别设计了如下4个实验方案:
甲方案:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
乙方案:应用钢铁吸氧腐蚀的原理,设计电池制备Fe(OH)2。
|
丙方案:按图实验,制备Fe(OH)2。 丁方案:按图实验,制备Fe(OH)2。(苯的作用是使电解质溶液隔绝空气)
回答下列问题:
①在甲方案中,所用FeSO4样品通常部分被氧化,写出在配制FeSO4溶液时,其操作过程及反应的离子方程式: 。
②在乙方案中,正极的电极反应式是: 。你认为该方案是否可行? ,若不可行请说明理由(若可行,则该空不需回答): 。
③在丙方案中,当容器B、A中均加入试剂并塞好橡皮塞后,还需要进行的操作是 。
④在丁方案中,在两电极之间的溶液中首先观察到白色沉淀。请写出b电极的电极反应式: 。则其电解质溶液可以是下列三项的 。
A.蒸馏水 B.NaC1溶液 C.NaOH溶液
Ⅰ.下表是诸暨市一百超市出售的“雪涛牌”加碘精制盐的有关说明:
产品标准号 | GB5461-2000 |
配 料 | 精制盐、碘酸钾、抗结剂 |
质量等级 | 一级 |
含碘量 | (35±15)mg/kg |
食用方法 | 待食品熟后加入碘盐 |
储藏方法 | 密判保存、防潮防热 |
分装日期 | 2008年10月8日 |
Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的一些信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。日前世界上碘主要来自钾利硝石,其中含碘O.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性。如:
2Nal+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 (一)
2NaIO3+5NaHSO3=2NaSO4+3NaHSO4+H2O+I2 (二)
反应(一)是从海藻灰中提取碘的主要反应,反应(三)是从智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
(1)反应(一)中NaI被 (填“氧化”或“还原”,下同);反应(二)中NaIO3是 剂,若有1.5mol NaIO3发生了反应,则转移的电子是 mol。
(2)下面是某同学设计的,探究上述“雪涛牌”精制盐中是否真的含有碘元素的实验。请你完成空白部分。
实验名称: ① 。
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应
2.认识碘单质的检验方法
实验用品:试管、胶头滴管、“雪涛牌”精制盐、亚硫酸氢钾溶液、淀粉溶液。
实验步骤:
实验步骤 | 实验现象 | 化学方程式或实验结论 |
1.取精制盐少许于一支试管 中,加入适量的水,振荡 | 固体在 水中溶解 | “雪涛牌”精制盐能溶于水 |
2.向上述溶液中滴加适量的亚 硫酸氢钾溶液,振荡 | 溶液变成 棕黄色 | ②(填化学方程式) |
3.再向上述溶液中滴加淀粉溶 液,振荡 | ③ | “雪涛牌”精制盐中含有碘元素 |
问题讨论:我省的温州有很长的海岸线,海产品丰富,海产品中或多或少含有碘元素,而海产品又是温州人的主要副食品,那么温州人的食用盐中需要加碘吗?
并说说你的理由。
④ 。