题目内容
【题目】成都七中化学兴趣小组在实验室制备 1,2-二溴乙烷,能使用的药品有乙醇、Br2 的 CCl4溶液以及浓硫酸等。反应装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)用两个化学方程式表示该实验原理:_____________;_________________
(2)用两个化学方程式表示该实验中可能存在的副反应:______________;______________
(3)装置 A 中使用到了恒压滴液漏斗的目的是:_____。装置 B 的目的是:_____________
(4)为保证 D 中尽可能少出现杂质产物,在装置 C 中应加入_____ (填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.酸性 KMnO4 溶液
(5)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”); 若产物中有少量副产物乙醚.可用_____的方法除去;
(6)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.亚硫酸钠溶液
(7)反应过程中应用冷水冷却装置 D,其主要目的是_____;
【答案】 CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2 Br 2C2H5OH
CH2=CH2↑+H2O CH2=CH2+Br2→CH2BrCH2 Br 2C2H5OH![]() C2H5—O—C2H5+H2O C+2H2SO4(浓) ==CO2↑+2SO2↑+2H2O或 C2 H5OH+6H2SO4(浓) == 2 CO2↑+6SO2↑+9H2O 平衡气压,使液体顺利滴下 安全瓶 c 下 蒸馏 d 防止液 Br2 挥发
C2H5—O—C2H5+H2O C+2H2SO4(浓) ==CO2↑+2SO2↑+2H2O或 C2 H5OH+6H2SO4(浓) == 2 CO2↑+6SO2↑+9H2O 平衡气压,使液体顺利滴下 安全瓶 c 下 蒸馏 d 防止液 Br2 挥发
【解析】(1)实验室用乙醇、Br2的CCl4溶液以及浓硫酸等药品制1,2-二溴乙烷,反应原理为:①乙醇在浓硫酸作用下消去反应生成乙烯;②乙烯与Br2发生加成反应。故反应化学方程式为:CH3CH2OH![]() CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br。
CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br。
(2)该反应原理中,乙醇在浓硫酸、140℃时会发生分子间脱水生成乙醚;在温度高于170℃时,和乙醇会被浓硫酸碳化进一步生成CO2等物质。故副反应为:2C2H5OH![]() C2H5—O—C2H5+H2O、C+2H2SO4(浓)
C2H5—O—C2H5+H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O或C2H5OH+6H2SO4(浓)
CO2↑+2SO2↑+2H2O或C2H5OH+6H2SO4(浓)![]() 2CO2↑+6SO2↑+9H2O。
2CO2↑+6SO2↑+9H2O。
(3)A是制取乙烯的装置,使用恒压滴液漏斗可以保证漏斗和三颈瓶内压强相等,有利于液体顺利滴下;B做安全瓶,平衡气压,防止倒吸。
(4)由于在反应过程中可能生成SO2和CO2,为保证D中尽可能少出现杂质产物,在装置C中应加入氢氧化钠溶液,用来吸收反应中可能生成的酸性气体,防止干扰实验。
(5)由已知,1,2-二溴乙烷的密度比水的大,所以将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;乙醚的沸点和1,2-二溴乙烷的沸点相差很大,所以产物中有少量副产物乙醚,可用蒸馏的的方法除去。
(6)若1,2-二溴乙烷中混有少量未反应的Br2,a项,Br2在水中溶解度不大,故a不合适;b项,Br2能与氢氧化钠溶液反应,但1,2-二溴乙烷在氢氧化钠溶液中可能水解,故b不是最好;c项,Br2与碘化钠溶液反应生成I2,易溶于有机溶剂,会溶解到1,2-二溴乙烷中,故c不合适;d项,Br2与亚硫酸钠溶液反应从而被除去,并且不影响1,2-二溴乙烷,故d最好。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】
反应原理:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。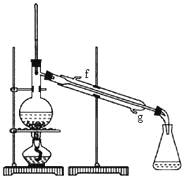
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
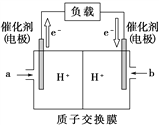
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。




