题目内容
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为
| A.6 :3 :2 | B.3 :2 :1 | C.6 :3 :1 | D.1 :2 :3 |
A
解析试题分析:生成的沉淀即氯化银物质的量相等,说明氯化钠、氯化镁、氯化铝中Cl?物质的量相等,设Cl?物质的量为nmol,则氯化钠的物质的量为nmol,氯化镁的物质的量为1/2nmol,氯化铝的物质的量为1/3nmol,三种溶液体积相同,所以原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为n:1/2n:1/3n=6:3:2,故A项正确。
考点:本题考查化学方程式及物质的量浓度的计算。

练习册系列答案
相关题目
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是( )
| A.标准状况下11.2 L氯气 | B.17g氨气 |
| C.0.8mol氧气 | D.4℃时,36mL的H2O |
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
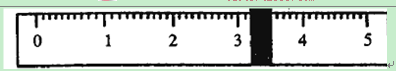
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响
(用偏大、偏小、无影响填写)
下列表述与化学用语正确的是
A.CO2的比例模型 |
B.氢化铵的电子式: 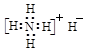 |
C.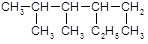 的名称:2,3-二甲基-4-乙基己烷 的名称:2,3-二甲基-4-乙基己烷 |
D.乙酸乙酯水解: |
下列叙述正确的是
| A.3.01×1023个SO2分子的质量为32g |
| B.CH4的摩尔质量为16g |
| C.1 mol H2O的质量为18g/mol |
| D.标准状况下,1 mol任何物质体积均为22.4L |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1molFe与过量的稀HNO3反应,转移2 NA个电子 |
| C.1mol/L NaCl溶液含有NA个Na+ |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
| B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
| C.1 mol —OH中电子数为10 NA |
| D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)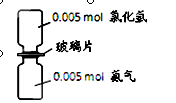
| A.反应前气体反应物的总体积为0.224 L |
| B.生成物的分子个数为0.005 NA |
| C.产物中的N-H键个数为0.02NA |
| D.加水溶解后所得溶液中NH4+数目为0.005 NA |
下列有关化学用语使用正确的是
A.CH4分子的球棍模型: |
| B.乙烯的结构简式:CH2CH2 |
C.S的结构示意图: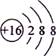 |
D.原子核内有l8个中子的氯原子: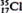 |