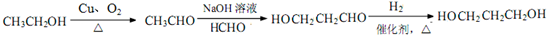题目内容
20.已知常温下,H2CO3:Ki1=4.3x10-7、Ki2=5.6x10-11.结合H+的能力Na2CO3溶液>(填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:取等浓度等体积的NaHCO3和Na2CO3溶液混于同一烧杯中,加入稀盐酸,边滴边搅拌,若一段时间无气泡,则Na2CO3结合H+能力强.分析 电解质越弱,其相应的阴离子结合质子能力越强,常温下,H2CO3:Ki1=4.3x10-7>Ki2=5.6x10-11,电离强弱顺序是碳酸的一级电离大于其二级电离,即结合H+的能力Na2CO3溶液大于NaHCO3溶液,根据同浓度的两溶液与盐酸反应生成气体的速率进行设计实验证明.
解答 解:电解质越弱,其相应的阴离子结合质子能力越强,常温下,H2CO3:Ki1=4.3x10-7>Ki2=5.6x10-11,电离强弱顺序是:碳酸的一级电离大于其二级电离,即结合H+的能力Na2CO3溶液大于NaHCO3溶液,取等浓度等体积的NaHCO3和Na2CO3溶液混于同一烧杯中,加入稀盐酸,边滴边搅拌,若一段时间无气泡,则Na2CO3结合H+能力强,
故答案为:>;取等浓度等体积的NaHCO3和Na2CO3溶液混于同一烧杯中,加入稀盐酸,边滴边搅拌,若一段时间无气泡,则Na2CO3结合H+能力强.
点评 本题考查了弱电解质的电离,根据电离平衡常数进行分析是解答关键,题目难度不大.

练习册系列答案
相关题目
11.铁与铁合金是生活中常见的材料,下列说法正确的是( )
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和强度均高于铁合金 |
8.下列符合化学实验“绿色化”原则的是( )
①在实验室用双氧水代替高锰酸钾分解制取氧气
②在实验室的废酸液与废碱液中和后再排放
③在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝.
①在实验室用双氧水代替高锰酸钾分解制取氧气
②在实验室的废酸液与废碱液中和后再排放
③在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
15.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量15%的Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
12.下列叙述正确的是( )
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | 酸式盐的水溶液呈酸性 | |
| C. | 盐类水解是中和反应的逆反应 | |
| D. | 凡是强酸生成的盐,其水溶液呈中性 |
9.标准状态下,体积最大的物质是( )
| A. | 22.4L氢气 | B. | 含3.01×1023个分子的硫化氢 | ||
| C. | 10g氨(NH3) | D. | 0.8mol二氧化硫 |
10.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的熵增 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
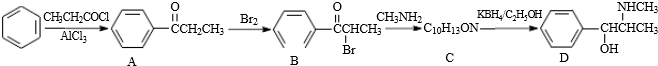
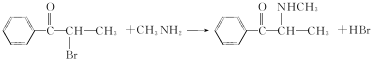 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.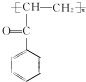
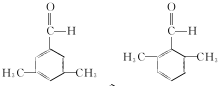 (写结构简式).
(写结构简式). 参照上述合成路线,设计一条由苯和乙酸为起始原料制备
参照上述合成路线,设计一条由苯和乙酸为起始原料制备 的合成路线:
的合成路线: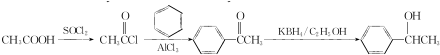 .
.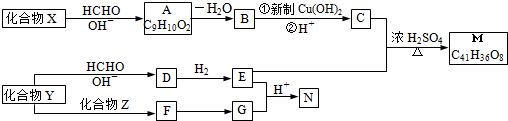
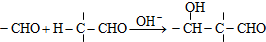
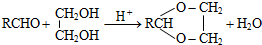
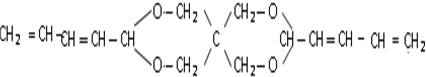
 Z:CH2=CHCHO E:
Z:CH2=CHCHO E:
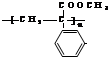 .
.