题目内容
下列关于反应热的说法正确的是:
A.已知C(石墨,s)  C(金刚石,s) △H>0,说明金刚石比石墨稳定
C(金刚石,s) △H>0,说明金刚石比石墨稳定
B.已知H+(aq) + OH-(aq)  = H2O(l) △H= -57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
= H2O(l) △H= -57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g) + 2O2 (g) = CO2(g) + 2H2O(g) △H= -890.3kJ/mol
D.将0.5molN2和1.5molH2置于密闭容器中充分反应达到平衡时,放出热19.3kJ的热量,其热化学方程式为:N2(g) + 3H2(g)  2NH3(g) △H= -38.6kJ/mol
2NH3(g) △H= -38.6kJ/mol
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应:
N2(g)+3H2(g) 2NH3(g) △H=-93 kJ/mol。
2NH3(g) △H=-93 kJ/mol。
试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
化学键 | H-H | N-H | N≡N |
键kJ/mol | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变△H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。
(4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。


 要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
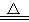 NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑

 池工作时电子由b极沿导线经灯泡再到a极
池工作时电子由b极沿导线经灯泡再到a极