题目内容
某铜合金(含Mg、Al)粉碎后,取5.72 g使之充分溶解在稀H2SO4中,收集到产生的气体2.8 L(标况),将不溶物与稀HNO3反应,有2.1 g HNO3被还原。求合金中各成分的质量分数。
提示:
| 依Mg、Al与稀H2SO4反应及Cu与稀HNO3反应中量的关系进行计算。
Mg ~ H2 2Al ~ 3H2 3Cu ~ 2NO ~ 2HNO3 1 mol 1 mol 2 mol 3 mol 3×64 g 2×63 g x x 2y 3y ∴ 3.2 g ∵ 2.1 g
∴Cu%= Mg%= Al%=
|

 中考解读考点精练系列答案
中考解读考点精练系列答案某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
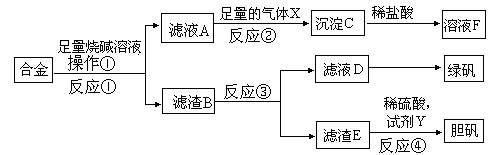
请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3??6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3??6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
| 实验编号 | 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 1 | 11.2g | 25.1g | 19.2g |
| 2 | 11.2g | 25.1g | 18.8g |
| 3 | 11.2g | 25.1g | 18.9g |
 , 解得
, 解得