题目内容
11. 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g(1)SiCl4的平均反应速率为0.015mol/(L.min).
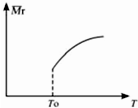
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示.下列说法正确的是AB
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.v逆(N2)=3v正(H2),则上述反应己达到平衡状态
E.达到平衡状态时,反应物不再转化为生成物
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在T3(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长.假设温度为T1时向该反应容器中同时加入:(SiC14)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c (HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为0≤x<0.15.
| 温度T | T1 | T2 | T3 |
| 平衡常数K | 1.2 | 2.5 | 10 |
分析 (1)固体的质量增加了2.80g为Si3N4的质量,根据n=$\frac{m}{M}$计算其物质的量,根据方程式计算消耗SiCl4的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(SiCl4);
(2)由图可知,随温度升高,SiCl4(g)的转化率降低,说明正反应为放热反应,结合外界条件对平衡移动影响及利用平衡的特征“等”、“定”及由此衍生的一些量来分析;
(3)温度越低,反应速率越慢,到达平衡时间越长;据Q与K的数值比较判断反应方向.
解答 解:(1)固体的质量增加了2.80g为Si3N4的质量,其物质的量$\frac{2.8g}{140g/mol}$=0.02mol,根据方程式可知消耗SiCl4的物质的量=0.02mol×3=0.06mol,故v(SiCl4)=$\frac{\frac{0.06mol}{2L}}{2min}$=0.015mol/(L.min),
故答案为:0.015mol/(L.min);
(2)A.由图可知,随温度升高,SiCl4(g)的转化率降低,说明正反应为放热反应,即△H<0,故A正确;
B.Si3N4是固体,随反应进行混合气体的总质量减小,若混合气体的总质量不变,表明上述反应己达到平衡状态,故B正确;
C.Si3N4是固体,增大其物质的量,不影响平衡移动,故C错误;
D.降低温度,平衡向正反应方向移动,混合气体总质量减小,混合气体总物质的量增大,混合气体的平均相对分子质量减小,故D错误,
故答案为:AB;
(3)正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故温度T1>T2>T3,温度越低,反应速率越慢,到达平衡时间越长,即温度T3达到平衡时间最长;Q=$\frac{[HCl]^{12}}{[SiCl]^{3}•[{N}_{2}]^{2}•[{H}_{2}]^{6}}$<K=1.2时,平衡逆向移动,0≤x<0.15时符合,故答案为:T3;0≤x<0.15.
点评 本题考查化学反应速率计算、外界条件对平衡移动影响、平衡常数影响因素,题目难度中等,注重对常考知识点的考查,能较好的体现学生分析解答问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 | |
| B. | SO2溶于水后,其水溶液可以导电,所以SO2属于电解质 | |
| C. | 当光束照射云、烟、雾时,均可看到明显的光路,是因为三者都属于胶体 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
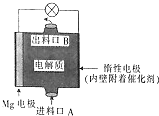 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )| A. | 惰性电极是该电池的正极 | |
| B. | 电解质中的多数ClO-向电池的负极移动 | |
| C. | 电池中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 进料口A进入的是NaClO溶液,而出料口B输出的则是NaCl溶液 |
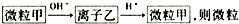 ,则甲是( )
,则甲是( )| A. | Fe2+ | B. | Mg2+ | C. | Al | D. | CO2 |
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
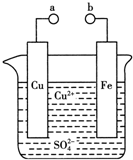
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu | |
| C. | a和b用导线相连时,电能转变为化学能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| A. | X是第二周期元素 | B. | Y是第ⅦA族元素 | ||
| C. | Y-与X2+的最外层电子数相同 | D. | 化合物XY2的化学键为离子键 |