题目内容
(1)3.01×1024个微粒,其物质的量是 mol.(2)O2和O3混合物64g,其氧原子物质的量是 mol.
(3)在标准状况下,氢气和氧气混合气体67.2L,其物质的量是 mol.
(4)有一瓶浓度为4mol/L体积为250mLNa2SO4溶液,Na+物质的量是 mol.
【答案】分析:(1)根据 计算物质的量;
计算物质的量;
(2)根据 计算物质的量;
计算物质的量;
(3)根据n=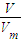 计算物质的量,
计算物质的量,
(4)根据n=c?V计算物质的量.
解答:解;(1) =
= =5mol,故答案为:5;
=5mol,故答案为:5;
(2)O2和O3都由氧原子组成, =
= 4mol,故答案为:4;
4mol,故答案为:4;
(3)在标准状况下,氢气和氧气混合气体67.2L,其物质的量是:n= =
= =3mol,故答案为:3;
=3mol,故答案为:3;
(4)4mol/L体积为250mLNa2SO4溶液中,n(Na2SO4)=4mol/L×0.25L=1mol,n(Na+)=2n(Na2SO4)=2mol,故答案为:2.
点评:本题考查物质的量的有关计算,题目难度不大,注意物质的量与粒子数目、质量、体积等物理量的计算.
 计算物质的量;
计算物质的量;(2)根据
 计算物质的量;
计算物质的量;(3)根据n=
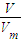 计算物质的量,
计算物质的量,(4)根据n=c?V计算物质的量.
解答:解;(1)
 =
= =5mol,故答案为:5;
=5mol,故答案为:5;(2)O2和O3都由氧原子组成,
 =
= 4mol,故答案为:4;
4mol,故答案为:4;(3)在标准状况下,氢气和氧气混合气体67.2L,其物质的量是:n=
 =
= =3mol,故答案为:3;
=3mol,故答案为:3;(4)4mol/L体积为250mLNa2SO4溶液中,n(Na2SO4)=4mol/L×0.25L=1mol,n(Na+)=2n(Na2SO4)=2mol,故答案为:2.
点评:本题考查物质的量的有关计算,题目难度不大,注意物质的量与粒子数目、质量、体积等物理量的计算.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
(18分)金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。
请回答下列问题:
①试推测,在金属系列中,钛属于 (填“较活泼”或“较不活泼”)的金属。金属钛耐腐蚀可能原因是 。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为 。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化。有关氢氧化物开始沉淀的pH如表l
表l 有关氢氧化物开始沉淀的pH
| 氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
| pH | 0.5 | 3.0 | 1.5 | 7.6 |

图1 工艺流程图
黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式: ;加入Fe的目的是 ;步骤④生成Ti(OH)4的离子方程式: 。
(3)钛冶炼的新法是电解法,图2是一种电解制钛的工艺(OS法)示意图。CaC12/CaO共熔体为质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式 。

(4)我国科学最新研发的技术——固体透氧膜提取金属钛(SOM)工艺(见图3):将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阴极通入H2,则阳极电极反应式为 。
