题目内容
过氧化钠保存不当容易变质,某课外活动小组设计下图装置实验,图中的E和F构成量气装置,用来测定O2的体积.请你结合下列实验,回答下列问题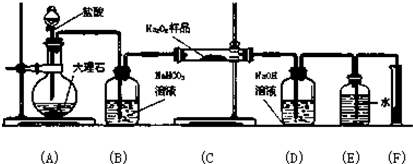
(1)实验操作前关键一步是
(2)B装置的作用是
(3)为了测定过氧化钠的质量分数,活动小组同学称取ag样品,实验完后读出量筒内水的体积数,并折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
分析:(1)依据装置图分析可知,测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好;
(2)装置图中(A)为生成二氧化碳的装置,(B)为洗气装置,(C)为二氧化碳与过氧化钠反应的装置,(D)为吸收多余的二氧化碳的装置,(E)和(F)是测量生成氧气的体积的装置;
(3)依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
(2)装置图中(A)为生成二氧化碳的装置,(B)为洗气装置,(C)为二氧化碳与过氧化钠反应的装置,(D)为吸收多余的二氧化碳的装置,(E)和(F)是测量生成氧气的体积的装置;
(3)依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
解答:解:(1)实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;
故答案为:检查装置的气密性;
(2)装置图中(A)为生成二氧化碳的装置,(B)为洗气装置,吸收二氧化碳中混有的HCl,防止HCl与过氧化钠反应,(C)为二氧化碳与过氧化钠反应的装置,(D)为吸收多余的二氧化碳的装置,防止多余的二氧化碳进入量气装置,导致测得的氧气的体积偏大,(E)和(F)是测量生成氧气的体积的装置;
故答案为:吸收二氧化碳中的HCl;吸收未反应的CO2;
(3)测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则氧气物质的量=
,2CO2+2Na2O2=2Na2CO3+O2,则过氧化钠的物质的量为2×
;样品中过氧化钠的质量分数为=
×100%=
%;
故答案为:
%.
故答案为:检查装置的气密性;
(2)装置图中(A)为生成二氧化碳的装置,(B)为洗气装置,吸收二氧化碳中混有的HCl,防止HCl与过氧化钠反应,(C)为二氧化碳与过氧化钠反应的装置,(D)为吸收多余的二氧化碳的装置,防止多余的二氧化碳进入量气装置,导致测得的氧气的体积偏大,(E)和(F)是测量生成氧气的体积的装置;
故答案为:吸收二氧化碳中的HCl;吸收未反应的CO2;
(3)测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则氧气物质的量=
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| ||
| a |
| 39V |
| 56a |
故答案为:
| 39V |
| 56a |
点评:本题考查了物质组成的实验探究方法,实验设计方法,实验计算应用,装置图的分析判断是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。
高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。 高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。
高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。 高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。
高#考#资#源上图中的E和F构成量气装置,用来测定O2的体积。