题目内容
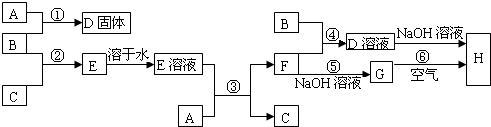
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,它们之间的转化关系如图所示(反应条件及部分生成物已略去).其中,组成单质A的元素在地壳中的含量居第四位;纯净的C可以在B中安静地燃烧,发出苍白色火焰.请按要求回答问题:

(1)写出A、B和C的化学式:A ,B ,C .
(2)B与F反应的离子方程式是 .
(3)A与D溶液反应的离子方程式是 .
(4)在实验室里,用下图装置制取纯净干燥的气体B.

①上图装置并不完善,请在方框内画出丁的装置图,并注明试剂名称.
②欲除去气体B中的HCl,甲装置中应选用的试剂为 (填序号).
a.饱和氢氧化钠溶液
b.饱和食盐水
c.饱和氨水
③仪器K、M的名称分别是 、 .乙装置中盛放的试剂名称为 ,其作用是 .
④实验室用MnO2与浓盐酸反应制取气体B,M中反应的离子方程式为 .

(1)写出A、B和C的化学式:A
(2)B与F反应的离子方程式是
(3)A与D溶液反应的离子方程式是
(4)在实验室里,用下图装置制取纯净干燥的气体B.

①上图装置并不完善,请在方框内画出丁的装置图,并注明试剂名称.
②欲除去气体B中的HCl,甲装置中应选用的试剂为
a.饱和氢氧化钠溶液
b.饱和食盐水
c.饱和氨水
③仪器K、M的名称分别是
④实验室用MnO2与浓盐酸反应制取气体B,M中反应的离子方程式为
分析:B为黄绿色气体,应为Cl2,组成单质A的元素在地壳中的含量居第四位,应为Fe,则D为FeCl3,纯净的C可以在B中安静地燃烧,发出苍白色火焰,可知C应为H2,生成E为HCl,F为FeCl2,结合物质的相关性质解答该题.
解答:解:B为黄绿色气体,应为Cl2,组成单质A的元素在地壳中的含量居第四位,应为Fe,则D为FeCl3,纯净的C可以在B中安静地燃烧,发出苍白色火焰,可知C应为H2,生成E为HCl,F为FeCl2,
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe;Cl2;H2;
(2)FeCl2和Cl2反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl3具有氧化性,可与Fe反应生成FeCl2,反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)①实验室制备氯气,因氯气有毒,气体不能排放到空气中,可用氢氧化钠溶液吸收,则丁应为尾气处理装置,装置图为 ,故答案为:
,故答案为: ;
;
②因氯气难溶于饱和食盐水,则可先将气体通过饱和食盐水,故答案为:b;
③由装置图可知K为分液漏斗,M为圆底烧瓶,为得到干燥的氯气,经除去HCl之后,再通过盛有浓硫酸的干燥瓶,可得到干燥的氯气,
故答案为:分液漏斗;圆底烧瓶;浓硫酸;干燥;
④实验室用MnO2与浓盐酸反应制取氯气,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe;Cl2;H2;
(2)FeCl2和Cl2反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl3具有氧化性,可与Fe反应生成FeCl2,反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)①实验室制备氯气,因氯气有毒,气体不能排放到空气中,可用氢氧化钠溶液吸收,则丁应为尾气处理装置,装置图为
 ,故答案为:
,故答案为: ;
;②因氯气难溶于饱和食盐水,则可先将气体通过饱和食盐水,故答案为:b;
③由装置图可知K为分液漏斗,M为圆底烧瓶,为得到干燥的氯气,经除去HCl之后,再通过盛有浓硫酸的干燥瓶,可得到干燥的氯气,
故答案为:分液漏斗;圆底烧瓶;浓硫酸;干燥;
④实验室用MnO2与浓盐酸反应制取氯气,反应的离子方程式为MnO2+4H++2Cl-
| ||
| ||
点评:本题考查无机物的推断,为高考常见题型,化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合,它不仅可考查学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法,解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等.

练习册系列答案
相关题目