题目内容
下列说法正确的是
- A.蔗糖、硫酸钡和碳酸分别属于非电解质、强电解质和弱电解质
- B.将FeCl3固体溶解于沸水中可制得Fe(OH)3胶体
- C.布朗运动是胶体微粒特有的运动方式,可以据此把胶体、溶液和悬浊液区别开来
- D.硫酸、熟石灰、纯碱和碱石灰分别属于酸、碱、盐和氧化物
A
分析:A.根据非电解质、强电解质以及弱电解质的概念来回答;
B.制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
C.布朗运动不是胶体的特有性质,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小;
D.硫酸、熟石灰、纯碱分别属于酸、碱、盐,碱石灰是混合物.
解答:A.蔗糖在水中只存在分子,硫酸钡在熔融状态下完全电离,碳酸在水中部分电离,所以它们分别属于非电解质、强电解质和弱电解质,故A正确;
B.将FeCl3固体溶解于沸水中,得不到胶体,得到的是浊液,制备Fe(OH)3胶体方法是向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色即可,反应为 FeCl3+3H2O Fe(OH)3(胶体)+3HCl,故B错误;
Fe(OH)3(胶体)+3HCl,故B错误;
C.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,对于液体中各种不同的悬浮微粒,都可以观察到布朗运动,所以依据布朗运动不可以把胶体、溶液和悬浊液区别开来,故C错误;
D.硫酸是强酸、熟石灰是强碱、纯碱是盐,碱石灰是氧化钙和氢氧化钠的混合物,故D错误;
故选A.
点评:本题主要考查了蔗糖、Fe(OH)3胶体、布朗运动、碱石灰等知识,掌握相关的概念和性质是解答的关键,本题比较基础,难度不大.
分析:A.根据非电解质、强电解质以及弱电解质的概念来回答;
B.制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
C.布朗运动不是胶体的特有性质,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小;
D.硫酸、熟石灰、纯碱分别属于酸、碱、盐,碱石灰是混合物.
解答:A.蔗糖在水中只存在分子,硫酸钡在熔融状态下完全电离,碳酸在水中部分电离,所以它们分别属于非电解质、强电解质和弱电解质,故A正确;
B.将FeCl3固体溶解于沸水中,得不到胶体,得到的是浊液,制备Fe(OH)3胶体方法是向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色即可,反应为 FeCl3+3H2O
 Fe(OH)3(胶体)+3HCl,故B错误;
Fe(OH)3(胶体)+3HCl,故B错误;C.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,对于液体中各种不同的悬浮微粒,都可以观察到布朗运动,所以依据布朗运动不可以把胶体、溶液和悬浊液区别开来,故C错误;
D.硫酸是强酸、熟石灰是强碱、纯碱是盐,碱石灰是氧化钙和氢氧化钠的混合物,故D错误;
故选A.
点评:本题主要考查了蔗糖、Fe(OH)3胶体、布朗运动、碱石灰等知识,掌握相关的概念和性质是解答的关键,本题比较基础,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.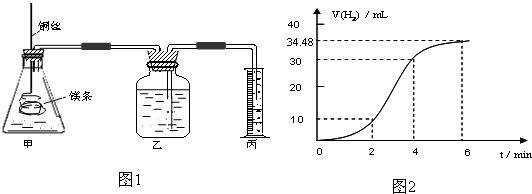
(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是 .(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为 .(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
①上表中V1= mL,V3= mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是 .
③若实验测得t2>t3>t4,则可得出的实验结论是 .

(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是
③若实验测得t2>t3>t4,则可得出的实验结论是


 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.