题目内容
18.对于同一周期从左到右的主族元素,下列说法中,正确的是( )| A. | 原子半径逐渐增大 | B. | 原子的得电子能力逐渐减弱 | ||
| C. | 最高正化合价逐渐减小 | D. | 元素的金属性逐渐减弱 |
分析 同一周期从左到右的主族元素,原子半径在减小、金属性减弱、非金属性增强,最外层电子数增大,以此来解答.
解答 解:A.同一周期从左到右的主族元素,原子半径逐渐减小,故A错误;
B.同一周期从左到右的主族元素,原子的得电子能力逐渐增强,非金属性增强,故B错误;
C.同一周期从左到右的主族元素,以第三周期为例,最外层电子数增大,最高正化合价逐渐增大,故C错误;
D.同一周期从左到右的主族元素,原子的失电子能力逐渐减弱,金属性逐渐减弱,故D正确;
故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、同周期元素性质变化规律为解答的关键,注意理解元素周期律,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
9.下列说法正确的是( )
| A. | 若完全燃烧,1 mol雌酮(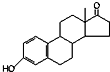 )比雄酮( )比雄酮(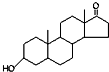 )多消耗3 mol O2 )多消耗3 mol O2 | |
| B. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| C. | 甲醛、甲酸、甲酸钠,均能发生银镜反应 | |
| D. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 |
6.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
13.下列说法正确的是( )
| A. | 放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少 | |
| B. | 1molH2SO4和1molBa(OH)2完全反应所放出的热量称为中和热 | |
| C. | 反应物的总能量低于生成物的总能量的化学反应为放热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
10.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 它们的熔沸点随核电荷数的增加而增加 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
7.海带中富含碘元素,有人设计如下步骤来提取碘:①通足量氯气;②将海带烧成灰,向灰中加水搅拌:③加入CCl4振荡;④过滤;⑤用分液漏斗分液.合理的操作顺序为( )
| A. | ②一①一④一③一⑤ | B. | ②一④一①一③一⑤ | C. | ①一③一⑤一②一④ | D. | ③一①一②一⑤一④ |
 ,F元素原子的电子排布式1s22s22p63s23p5,
,F元素原子的电子排布式1s22s22p63s23p5,