题目内容
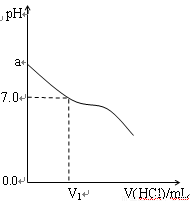
(16分)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值
刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)
(填<、>或=)。简要写出判断依据
。
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字)。
(16分)
(1)CH3COO- + H2OCH3COOH + OH- (3分)
(2)(6分) = (2分)
根据电荷守恒有:c(OH- ) +c(Cl- ) + c(CH3COO- ) = c(H+) +c(Na+) 由于溶液的pH=7,c(OH-) = c(H+),所以c(Cl- ) + c(CH3COO- ) = c(Na+) (2分);
而根据物料守恒有:c(CH3COO H) + c(CH3COO- ) = c(Na+) (1分)
所以有c(CH3COO H ) = c(Cl- ) (1分)
(3)解:当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH) =0.10mol/L (1分)
CH3COOHCH3COO- + H+ (2分)
c(平) 0.1 1.3×10-3 1.3×10-3 (1分)
![]()
解析:略

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
|
组别 |
NH3·H2O |
HCl |
混合溶液的pH值 |
|
甲 |
c(NH3·H2O)=0.1mol·L-1 |
c(HCl)=0.1mol·L-1 |
pH=a |
|
乙 |
NH3·H2O的pH=12 |
HCl的pH=2 |
pH=b |
|
丙 |
c(NH3·H2O)=A mol·L-1 |
c(HCl)=0.1mol·L-1 |
pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。

①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)