题目内容
用KMnO4氧化密度为1.19 g·cm-3、溶质质量为36.5%的HCl.反应方程式如下:
2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)15.8 g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl2在标准状况下的密度为3.17 g·L-1,则产生的Cl2在标准状况下的体积为多少?
答案:
解析:
解析:
|
答案:(1)29.2 g 18.25 g (2)5.6 L 思路解析:根据题目条件可得: 2KMnO4+16HCl 316 g 584 g 355 g 被氧化的HCl365 g(18.25 g) 15.8 g (29.2 g) (17.75 g) 所以产生的氯气在标准状况下的体积为 |

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
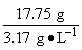 =5.6 L.
=5.6 L.