题目内容
将体积为17.92L(标准状况)二氧化碳,通入0.40L2.50mol/L的氢氧化钠溶液中,充分反应后,生成何种盐,其物质的量各为多少摩?
答案:
解析:
解析:
|
把二氧化碳通入氢氧化钠溶液中,发生的化学反应为:
当二氧化碳过量时,生成的碳酸钠又可进一步跟二氧化碳反应生成碳酸氢钠
本题给出的二氧化碳的物质的量为:
氢氧化钠的物质的量为: 0.40L×2.50mol/L=1.00mol 据此,依据上述反应①和②按照过量的一般方法可以算出生成的碳酸钠和碳酸氢钠的物质的量. 解法一、(常规解法)设
设过量的二氧化碳(0.80mol-0.50mol)耗用的
生成的盐中仍有 0.50mol-0.30mol=0.20mol 二、设生成 已知 依据碳原子守恒有:
依据钠离子守恒有:
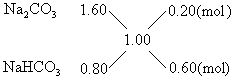
三、1.00molNaOH与0.80mol
所以,生成 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目