题目内容
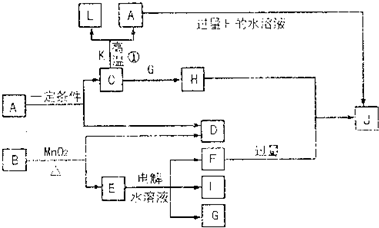
A~L为中学化学已学过的物质,相互间有如下转化关系(部分产物如H2O已略去).其中C、D、G、I均为短周期元素形成的单质,D、G、I为常见气态单质;D的原子最外层电子数是次外层电子数的3倍;C、G的元素同周期,且原子最外层电子数相差4;K为红棕色固体粉末.
请回答下列问题:
(1)D的元素与I的元素能形成原子个数比为1:1的共价化合物,其电子式为 .
(2)写出用石墨作电极,电解E的水溶液的离子方程式: .气体G在 极逸出(填“阳”或“阴”).
(3)写出C+K→L+A的化学方程式: ;该反应在工业上被称为 反应.
(4)写出A+F→J的离子方程式: .

请回答下列问题:
(1)D的元素与I的元素能形成原子个数比为1:1的共价化合物,其电子式为
(2)写出用石墨作电极,电解E的水溶液的离子方程式:
(3)写出C+K→L+A的化学方程式:
(4)写出A+F→J的离子方程式:
分析:D的元素的原子最外层电子数是次外层的3倍,应为O元素,则D为O2,K为红棕色固体粉末,应为Fe2O3,则C与K生成A的反应为铝热反应,C为Al,由转化关系可知A为Al2O3,L为Fe,则D为O2,B在二氧化锰加热条件下反应生成氧气,B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,能与铝反应的单质G为Cl2,则I为H2,F为KOH,H为AlCl3,J为KAlO2,结合对应物质的性质以及题目要求解答该题.
解答:解:D的元素的原子最外层电子数是次外层的3倍,应为O元素,则D为O2,K为红棕色固体粉末,应为Fe2O3,则C与K生成A的反应为铝热反应,C为Al,由转化关系可知A为Al2O3,L为Fe,则D为O2,B在二氧化锰加热条件下反应生成氧气,B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,能与铝反应的单质G为Cl2,则I为H2,F为KOH,H为AlCl3,J为KAlO2,
(1)D的元素与I的元素能形成原子个数比为1:1的共价化合物,应为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
(2)电解KCl水溶液,反应的化学方程式为:2KCl+2H2O
2KOH+Cl2↑+H2↑,G为Cl2,在阳极生成,故答案为:2KCl+2H2O
2KOH+Cl2↑+H2↑;阳;
(3)Al+Fe2O3→Fe+Al2O3的反应为铝热反应,化学方程式为Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3;铝热;
(4)A为氧化铝,F为氢氧化钾;J为偏铝酸钾,氧化铝与氢氧化钾反应生成偏铝酸钾与水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)D的元素与I的元素能形成原子个数比为1:1的共价化合物,应为H2O2,电子式为
 ,故答案为:
,故答案为: ;
;(2)电解KCl水溶液,反应的化学方程式为:2KCl+2H2O
| ||
| ||
(3)Al+Fe2O3→Fe+Al2O3的反应为铝热反应,化学方程式为Fe2O3+2Al
| ||
| ||
(4)A为氧化铝,F为氢氧化钾;J为偏铝酸钾,氧化铝与氢氧化钾反应生成偏铝酸钾与水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查结构与位置关系、无机推断、电解等,难度中等,推断物质是关键,突破口为D的原子结构与电解E的水溶液生成三种物质,其中两种为气态单质.进行推断验证,是对元素化合物知识的综合考查与对学生能力的考查.需对基础知识全面掌握.

练习册系列答案
相关题目
