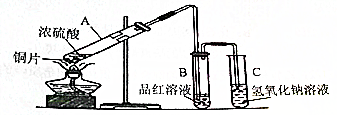
题目内容
14.已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )| A. | 该温度高于25℃ | |
| B. | c(H+)=c(OH-)+c(SO42-) | |
| C. | 水电离出来的c(H+)=1×10-10mol•L-1 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性 |
分析 A.纯水的pH=6,说明c(H+)=c(OH-)=1×10-6mol•L-1,Kw=1×10-12>1×10-14;
B.根据电荷守恒分析;
C.水电离出来的氢离子的浓度等于溶液中氢氧根的浓度;
D.纯水的pH=6,说明Kw=1×10-12,加入氢氧化钠溶液的物质的量应与氢离子的相等.
解答 解:A.纯水的pH=6,说明c(H+)=c(OH-)=1×10-6mol•L-1,Kw=1×10-12>1×10-14,水的电离时吸热过程,说明温度高于25℃,故A正确;
B.溶液呈电中性,则c(Na+)+(H+)=c(OH-)+2 c(SO42-),根据硫酸氢钠的化学式知c(Na+)=c(SO42-),所以(H+)=c(OH-)+c(SO42-),故B正确;
C.水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)=$\frac{1{0}^{-12}}{0.01}$=10-10 mol/L,故C正确;
D.Kw=1×10-12,应加入等体积浓度为0.01mol•L-1的氢氧化钠溶液,故应加入等体积pH=10的NaOH溶液,可使该溶液恰好呈中性,故D错误;
故选D.
点评 本题考查水的电离,注意水的离子积常数与溶液的温度有关,明确影响水电离的因素即可解答,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
4.下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
| A. | CH3-CHCl-CH2-CH3 | B. | 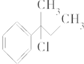 | ||
| C. | CH3-C(CH3)Cl-CH2-CH3 | D. | 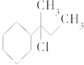 |
5.下列反应产物中,一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 丁烷与氯气光照条件下生成的一氯代物 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 2-丁烯与水的加成反应 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA | |
| B. | 1mol CH${\;}_{5}^{+}$中含有的电子数目为11NA | |
| C. | 28g聚乙烯中含有的碳原子数目为2NA | |
| D. | 0.1mol•L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA |
9.向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+3OH-?Cr(OH)3(灰蓝色)?CrO2-(绿色)+H++H2O.将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液.a、b试管中溶液颜色最终分别为( )
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |
6.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |
3.酒精分析器是交警检测驾驶员否饮酒的仪器,其原理是酒精与CrO3反应生成蓝绿色的Cr3+.根据颜色变化能判断是否饮过酒及饮酒量的多少.下列对乙醇性质的描述与此测定原理无关的是( )
| A. | 沸点低 | B. | 密度比水小 | C. | 乙醇溶于水 | D. | 具有还原性 |