题目内容
(6分)将3.2 g Cu与足量的浓硫酸在加热条件下充分反应。
(1)其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为 。
(3)若浓硫酸中含溶质为b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4) 0.5 b mol(填“>”、“<”或“=”)。
(1)其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为 。
(3)若浓硫酸中含溶质为b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4) 0.5 b mol(填“>”、“<”或“=”)。
(6分)(1)0.05mol (2) 1.8mol/L (3) <
答案:(1)0.05mol (2) 1.8mol/L (3) <
解析:3.2 g Cu为0.05mol
由方程式Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O可知:
CuSO4+SO2↑+2H2O可知:(1) 其中被还原的硫酸的物质的量为0.05mol,与被还原的铜相同。
(2) 稀释后所得溶液中SO42-的物质的量浓度为20.97 g÷233g/mol÷0.050L=1.8mol/L
(3) 随反应的进行浓硫酸变成稀硫酸,不再与铜反应,被还原的硫酸的物质的量n (H2SO4)<0.5 b mol

练习册系列答案
相关题目
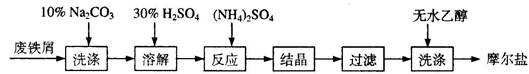
 CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10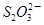 +I2
+I2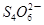 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。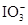 +5
+5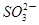 +2H+
+2H+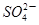 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 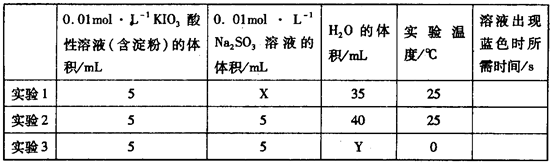
 Ce3++
Ce3++ 反应类型属于 反应。
反应类型属于 反应。