题目内容
已知在101 kPa、298 K条件下,2 mol H2燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )A.H2O(g)![]() H2(g)+
H2(g)+![]() O2(g) ΔH(298 K)=+242 kJ·mol-1
O2(g) ΔH(298 K)=+242 kJ·mol-1
B.2H2(g)+O2(g)![]() 2H2O(l) ΔH(298 K)=-484 kJ·mol-1
2H2O(l) ΔH(298 K)=-484 kJ·mol-1
C.H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH(298 K)=+242 kJ·mol-1
H2O(g) ΔH(298 K)=+242 kJ·mol-1
D.2H2(g)+O2(g)![]() 2H2O(g) ΔH(298 K)=+484 kJ· mol-1
2H2O(g) ΔH(298 K)=+484 kJ· mol-1
解析:在判断热化学方程式时,应注明以下几点:①标明各物质的状态,B中H2O的状态标错,B错。②标明反应是吸热还是放热,C、D应为负值,故C、D不正确。③若反应逆向进行,△H应改变符号,但绝对值不变,故A正确。
答案:A

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
下列说法正确的是( )
| A、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | B、铅蓄电池放电时的负极和充电时的阴极均发生还原反应 | C、已知:H2(g)+I2(g)?2HI(g);△H=-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 | D、已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ?mol-1 |

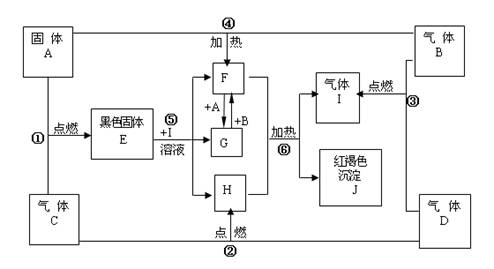
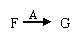 的转化中,A的作用是
;在①~⑥的反应中,不属于氧化还原反应的是
。(多填或少填无分)
的转化中,A的作用是
;在①~⑥的反应中,不属于氧化还原反应的是
。(多填或少填无分)