题目内容
NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1L 1.0 mol?L-1的NaAlO2水溶液中含有AlO2-为NA |
| B、1mol Na被完全氧化生成Na2O2,一定失去NA个电子 |
| C、1L 1 mol?L-1的盐酸含有NA个HCl分子 |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.偏铝酸根离子为弱酸根离子,水溶液中部分发生水解;
B.根据反应后钠元素的价态来分析;
C.氯化氢为强电解质,在水中完全电离;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮.
B.根据反应后钠元素的价态来分析;
C.氯化氢为强电解质,在水中完全电离;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮.
解答:
解:A.偏铝酸根离子为弱酸根离子,水溶液中部分发生水解,所以1L 1.0 mol?L-1的NaAlO2水溶液中含有AlO2-小于NA,故A错误;
B.1mol Na反应后钠元素的价态为+1价,故1mol钠失1mol电子,故B正确;
C.氯化氢为强电解质,在水中完全电离,所以盐酸中不存在氯化氢分子,故C错误;
D.标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故D错误;
故选:B.
B.1mol Na反应后钠元素的价态为+1价,故1mol钠失1mol电子,故B正确;
C.氯化氢为强电解质,在水中完全电离,所以盐酸中不存在氯化氢分子,故C错误;
D.标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故D错误;
故选:B.
点评:本题考查阿伏伽德罗常数的有关计算和判断,明确物质的量、粒子数、质量、体积等与阿伏伽德罗常数关系是解题关键,注意盐酸中无氯化氢分子.

练习册系列答案
相关题目






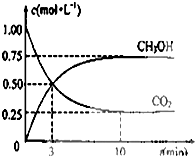 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)