题目内容
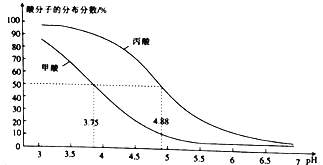
【题目】(1)25℃时,有体积和pH均相同的M和N两种溶液,加水稀释时,稀释的倍数与pH的变化关系如图所示:

①若两种溶液中的溶质分别为HCl和CH3COOH,则曲线___(填“I”或“II”)表示HCl溶液;当y=10时,x=___;稀释前,c(HCl)____c(CH3COOH)(填“>”“<”或“=”);
②若两种溶液中的溶质分别为HCl和NH4Cl,则a、b、c三点中,导电能力最强的是__;当向盐酸中加入n1molNaOH,向NH4Cl溶液中加入n2molNaOH时,两溶液恰好均呈中性,则n1__ n1(填“>”“<”或“=”)。
(2)已知常温下,0.1mol·L-1的NaHX溶液中,c(X2-)=1×10-3mol·L-1,且溶液中不存在H2X分子。
①HX-的电离方程式为___,常温下,HX-的电离平衡常数K=___;
②浓度为0.1mol·L-1的H2X溶液的pH=___;
③0.1mol·L-1的NaHX溶液中离子浓度由大到小排列的顺序为____________。
【答案】I 5 < a < HX-![]() H++X2- 1.0×10-5 1 c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)
H++X2- 1.0×10-5 1 c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)
【解析】
(1)①若两种溶质分别为盐酸和醋酸,加水稀释时,盐酸的电离程度增加,故Ⅰ为盐酸的曲线;加水稀释10倍时,盐酸溶液中H+浓度减小10倍。溶液pH变为5,则x=5,;稀释两溶液的pH相同,因醋酸为弱酸,在水溶液中部分电离,故醋酸浓度大于盐酸浓度;
②若两种溶质分别为盐酸和氯化铵,加水稀释时,盐酸的电离程度增加故Ⅰ为盐酸的曲线,此时a点的导电能力最强,盐酸的浓度小于氯化铵的浓度,此时向二者加入氢氧化钠溶液使两溶液的pH相同等于7,则盐酸需要的NaOH的物质的量小于氯化铵需要的物质的量;
(2)①0.1mol/L的NaHX溶液中X2-的浓度为0.001mol/L,说明X2-为弱酸根,故HX-的电离方程式为HX-![]() H++X2-;常温下HX-的电离平衡常数K=
H++X2-;常温下HX-的电离平衡常数K=![]() =
=![]() 10-5;
10-5;
②溶液中不存在H2X,说明H2X的一级电离是完全电离,故0.1mol/L H2X的pH=1;
③NaHX溶液呈酸性,不发生水解反应,HX-发生电离,则溶液中各离子浓度从大到小的顺序为c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)。

 名校课堂系列答案
名校课堂系列答案【题目】用如图所示装置和相应试剂能达到实验目的的是
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:N>C>Si | 稀硝酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 验证氧化性:Cl2>Br2 | 浓盐酸 | KMnO4 | FeBr2溶液 | |
C | 验证SO2有还原性 | 浓硫酸 | Na2SO3 | KMnO4溶液 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D