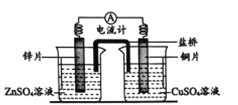
题目内容
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
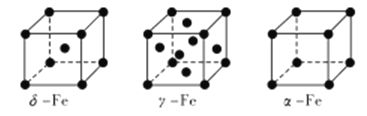
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
【答案】 [Ar]3d5 Fe3+的3d轨道为半充满状态,能量低稳定 3 哑铃(或纺锤) 正四面体形 sp3 4:3 4 
【解析】(1)Fe为26号元素,Fe3+的核外电子排布式为[Ar]3d5,Fe3+的3d轨道为半充满状态,能量低稳定,故Fe3+比Fe2+稳定;(2)因为氮原子的最外层有5个电子,其中2个是成对的,剩下的三个电子占据了三个p轨道,并且垂直分布,这样能量才能最低,则N的基态原子电子云在空间有3个方向,原子轨道呈哑铃或纺锤形;(3)(NH4)2SO4阴离子SO42-的中心S原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,sp3杂化,其立体构型是四面体形;NH4+中N原子杂化轨道数为![]() ×(5+4-1)=4,采取sp3杂化方式;(4)①根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶体晶胞中铁原子的配位数之比为4:3;②利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8×
×(5+4-1)=4,采取sp3杂化方式;(4)①根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶体晶胞中铁原子的配位数之比为4:3;②利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4;③由晶胞示意图可知,δ-Fe单质为体心立方堆积,铁原子为面心和顶点,则一个晶胞中Fe的个数为1+8×
=4;③由晶胞示意图可知,δ-Fe单质为体心立方堆积,铁原子为面心和顶点,则一个晶胞中Fe的个数为1+8×![]() =2,一个晶胞的质量为
=2,一个晶胞的质量为![]() ,体心结构中,体对角线长为4rpm,晶胞边长为
,体心结构中,体对角线长为4rpm,晶胞边长为![]() ,晶胞体积为
,晶胞体积为![]() cm3,故密度为
cm3,故密度为 。
。

【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等.利用炼铝厂的废料﹣铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾.工艺流程如下:
回答下列问题:

(1)明矾净水的原理是(用离子方程表示)________________;
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、________、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是________(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4﹣转化为Mn2+)________________。
已知:生成氢氧化物沉淀的pH如下表所示
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L﹣1
根据表中数据解释调pH=3的目的________________。
(5)已知:在pH=3、加热条件下,MnO4﹣可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为________________________。
【题目】
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。