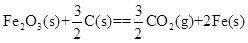题目内容
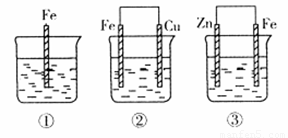
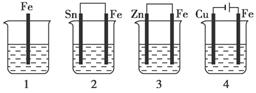
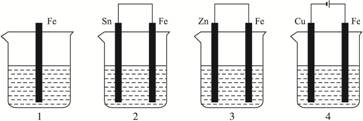
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )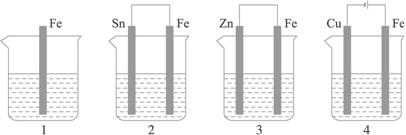
A.4>2>1>3 B.2>1>3>
解析:金属的腐蚀,从本质上讲是形成原电池发生氧化还原反应的结果。在原电池中,活泼金属为负极,该金属被氧化,不活泼金属便被保护起来,被腐蚀的速度大大减小,所以装置3中的铁被腐蚀的速度比1中的慢;反之,当铁与不如它活泼的金属,如Sn、Cu等连接起来时,则其被腐蚀的速度加快,所以在容器2中的铁比容器1中的铁腐蚀得快。容器4是电解池,Fe是阳极,不断地以Fe2+的形式进入容器中,从而加速了铁的腐蚀,在上述四种容器中,容器4中的铁的腐蚀过程是最快的。综上分析,按铁被腐蚀的快慢顺序为:4>2>1>3。
答案:A

练习册系列答案
相关题目

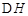 =-2830kJ·mol-1
=-2830kJ·mol-1